Übersicht
Thymosin beta 4 (Tβ4) ist ein kleinmolekulares Protein, das aus mehreren Aminosäureresten besteht und in verschiedenen Geweben und Zellen des menschlichen Körpers weit verbreitet ist.[1][2] Als eines der wichtigsten Aktin-regulierenden Moleküle im menschlichen Körper hat es zahlreiche biologische Funktionen und spielt eine entscheidende Rolle bei der Geweberegeneration, dem Umbau, der Wundheilung, der Aufrechterhaltung des Aktin-Gleichgewichts, der Tumorentwicklung und Metastasierung, der Zellapoptose, der Entzündung, der Angiogenese, der Haarfollikelentwicklung und anderen physiologischen und pathologischen Prozessen.
Biologische Funktionen und Wirkungsmechanismen
Tβ4 ist eines der wichtigsten Aktin-regulierenden Moleküle im menschlichen Körper und hat zahlreiche biologische Funktionen. Es spielt eine wichtige Rolle bei der Geweberegeneration, dem Umbau, der Wundheilung, der Aufrechterhaltung des Aktin-Gleichgewichts, der Tumorentwicklung und Metastasierung, der Zellapoptose, der Entzündung, der Angiogenese, der Haarfollikelentwicklung und anderen physiologischen und pathologischen Prozessen.
Quelle: Tandfonline
- Aktin-regulierender Faktor: Aktin macht etwa 10% des Gesamtproteins in Nicht-Muskelzellen aus und ist ein wesentlicher Bestandteil, der für die Zellstruktur, die Zellbewegung und die Wundheilung erforderlich ist. Die Anwesenheit von Tβ4 in Zellen reicht aus, um alle Aktinmonomere zu sequestrieren und an der Regulierung der Aktinpolymerisation und -depolymerisation teilzunehmen. Tβ4 kann an Aktinmonomere in einem Verhältnis von 1:1 binden und so die Bildung von F-Aktin-Polymeren verhindern. Die Bindung von Tβ4 an Aktin wird von der Dissoziation von gebundenem Wasser begleitet. Der C-Terminus von Tβ4 bindet an das Aktin His-40 und bewirkt eine Konformationsänderung der Aktinmonomere. Das Tβ4-Molekül enthält eine Aktin-bindende Domäne (LKKTET), die die wichtigste elektrostatische Kontaktstelle darstellt. Sein N-terminales Fragment kann die Aktinpolymerisation durch sterische Hinderung hemmen. Wenn es allein wirkt, kann Tβ4 die Aktinpolymerisation und den Nukleotidaustausch auf Aktin hemmen. Dies steht im Gegensatz zur Rolle eines anderen Aktin-bindenden Proteins, Profilin, das den Austausch von ADP und ATP fördert und damit den Aktinaufbau beschleunigt. [1][2]Tβ4 und Profilin können den Aktinaufbau synergistisch regulieren. Tβ4 kann die Umwandlung zwischen G-Actin und F-Actin regulieren. Es wurde berichtet, dass die Konzentration von Tβ4 in hochmobilen Blutzellen 300 pmol erreicht, während die für die Bindung von Tβ4 an G-Actin erforderliche Konzentration weniger als 20 pmol beträgt. Mit zunehmender Konzentration verringert Tβ4 die Depolymerisationsfähigkeit von F-Actin. Dies könnte der Grund sein, warum Tβ4 die Funktion des zellulären Mikrofilamentsystems reguliert.
Förderung der Migration von Endothelzellen und der Angiogenese: Studien unter Verwendung des Angiogenesemodells mit der Chorioallantoismembran (CAM) von Hühnern haben gezeigt, dass bei der Differenzierung von Endothelzellen in röhrenförmige Strukturen der mRNA-Gehalt von Tβ4 um das Fünffache ansteigt und die Transfektion mit Tβ4 die Bildung von röhrenartigen Strukturen in Endothelzellklonen beschleunigt. Darüber hinaus hat die Forschung herausgefunden, dass Tβ4 mit Fibrin und Kollagen interagieren kann, vermittelt durch Transglutaminase (Faktor XIIIa), und eine wichtige Rolle im Prozess der Blutgerinnung spielt. Darüber hinaus kann Tβ4 in einem Experiment mit Hautverletzungen über die gesamte Dicke bei alternden diabetischen Mäusen die Heilung großflächiger Hautwunden und tiefer Verbrennungen beschleunigen, die Reparatur von Haut und Hornhaut fördern und die Fähigkeit zur Beschleunigung der Wundheilung nachweisen.
Hemmung der Zellapoptose: Tβ4 hat eine signifikante Schutzwirkung auf Hornhautepithelzellen, die durch ätzende Substanzen wie Benzalkoniumchlorid oder Ethanol geschädigt wurden. Die Hochregulierung der Tβ4-Genexpression ist vorteilhaft für die Verbesserung der Hypoxieresistenz der Zellen.[2][3]
Herunterregulierung wichtiger Entzündungsmoleküle: Die Wundheilung ist ein komplexer biologischer Prozess, der in drei verschiedene Phasen unterteilt werden kann: Entzündung, Zellproliferation und Gewebeumbau, wobei die Genexpression relevanter Proteine in jeder Phase hoch- und dann herunterreguliert wird. Bei chronischen Wunden kann dieser Regulierungsprozess durch Faktoren wie Alter, Grunderkrankungen und immunsuppressive Medikamente gestört werden, was zu einer übermäßigen Produktion von Entzündungsmolekülen, einer übermäßigen Entzündung und einer behinderten Zellproliferation und Gewebeumstrukturierung führt. Forschungen haben ergeben, dass Tβ4 den Gehalt an freien Radikalen reduzieren, die Lipidperoxidation verlangsamen, die Produktion von Entzündungszytokinen wie IL-1, Makrophagen-Entzündungsprotein 1α (MIP1α), MIP1β, monozytenchemotaktisches Protein-1 (MCP-1) hemmen, den Thromboxan- und Prostaglandin-2α-Spiegel senken und dadurch die Entzündung lindern kann. Daher kann es für die Behandlung von entzündlichen Erkrankungen wie segmentale Enteritis und Muskelschwund verwendet werden.
Stimulation der Differenzierung adulter epikardialer Stammzellen: Tβ4 spielt eine entscheidende Rolle bei verschiedenen Aspekten der Entwicklung von Koronargefäßen und kann das Wachstum von ruhenden adulten Epikardtransplantaten der Maus signifikant stimulieren, indem es die Multipotenz von Fibroblasten, glatten Muskelzellen und Endothelzellen wiederherstellt und ihre Differenzierung induziert.[1][2] Die Ausschaltung des Tβ4-Gens im Herzen führt zu einer signifikanten Verringerung der Menge des angiogenen Spaltprodukts von Tβ4 (AcSDKP). Obwohl die Injektion von AcSDKP das Herz nicht wiederherstellen kann, kann sie die Differenzierung adulter epikardialer Vorläuferzellen der Maus in Endothelzellen deutlich verbessern. Dies deutet darauf hin, dass Tβ4 und AcSDKP potente Stimulatoren der Koronar- und Neovaskularisation sind und Tβ4-induzierte adulte epikardiale Zellen der Maus als Quelle der vaskulären Regeneration dienen können, was zu einer nachhaltigen Regeneration der beeinträchtigten Gefäße auf niedrigem Niveau nach einer Herzverletzung führt.
Stimulierung der Entwicklung der Haarfollikel: Tβ4 fördert die Migration, die Differenzierung und den Aufbau der extrazellulären Matrix von Haarfollikel-Stammzellen und reguliert so das Haarwachstum. Studien an Ratten und Mäusen haben ergeben, dass während des Haarwachstumszyklus eine bestimmte Untergruppe von Haarfollikel-Keratinozyten, die aus der Wulstregion stammen, in hohem Maße Tβ4 mitexprimieren, während Hautstammzellen ebenfalls in der Wulst des Haarfollikels vorhanden sind. Wenn die Tβ4-Konzentration im nanomolaren Bereich liegt, werden die Migration und Differenzierung von Stammzellen verstärkt, und die Anwesenheit von Tβ4 erhöht auch die Expression und Sekretion von Matrix-Metalloproteinase-2 (MMP-2), einem extrazellulären Matrix abbauenden Enzym.
Beziehung zur Tumorbildung: Eine Hochregulierung des Tβ4-Gens wurde in verschiedenen Tumorzellen beobachtet, darunter medulläres Schilddrüsenkarzinom, kolorektales Karzinom, hochmalignes Melanom, Brustkrebs und orales Plattenepithelkarzinom. Tβ4 kann die Expression des vaskulären endothelialen Wachstumsfaktors wirksam induzieren, die Angiogenese fördern und die Migrationsfähigkeit der Zellen aktivieren, was zur Bösartigkeit des Tumors führt. Die Hochregulierung der Tβ4-Expression führt zu einer Herabregulierung der E-Cadherin-Expression, wodurch die Zelladhäsion geschwächt wird, und zu einer verstärkten Expression von Matrix-Metalloproteinasen, was den Krebszellen einen Wachstumsvorteil und invasive Eigenschaften verleiht und somit zur Bösartigkeit beiträgt. Tβ4 besitzt anti-apoptotische Fähigkeiten, und eine erhöhte Expression von Tβ4 kann das Ausmaß der Zellapoptose verringern, möglicherweise weil Tβ4 die Freisetzung von Cytochrom c hemmt und die Einleitung des Apoptoseprozesses stört, was ein weiteres wichtiges Merkmal bösartiger Tumore ist.
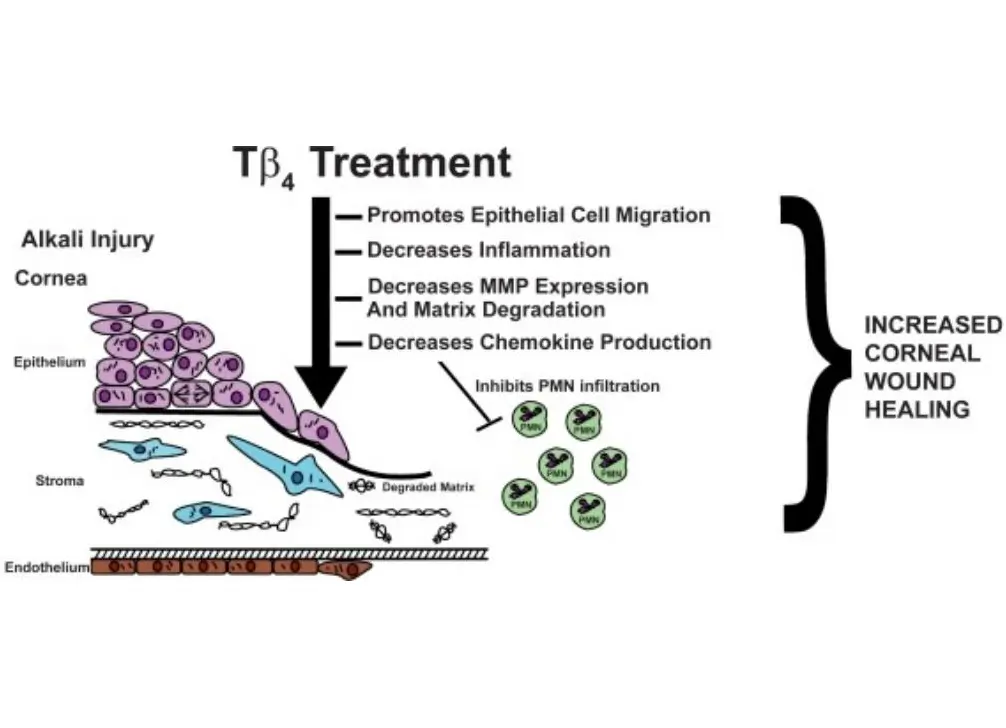
Förderung der Reparatur der Hornhaut: Thymosin β4 hat seine Fähigkeit unter Beweis gestellt, die Wundheilung in verschiedenen Hornhautverletzungsmodellen zu fördern und die Produktion bestimmter wichtiger Zytokine zu regulieren. Forschungen haben ergeben, dass Thymosin β4 die Expression von Matrix-Metalloproteinasen reduzieren, den Umbau der extrazellulären Matrix fördern und Zytokine aktivieren kann. Insbesondere hemmt es die Aktivität von Matrix-Metalloproteinasen, im Gegensatz zu den Schlussfolgerungen, die aus mit Thymosin β4 behandelten Hautverletzungsmodellen gezogen wurden. [1][2][3]Dies deutet darauf hin, dass die Regulationswege bestimmter Enzyme im Gewebereparaturprozess entweder hoch- oder herunterreguliert werden können.
Vorbereitung Methode
Derzeit gibt es zwei Hauptquellen für Thymosin beta 4 (Tβ4), die in klinischen und Forschungseinrichtungen verwendet werden: die Extraktion aus Rinderthymus und die chemische Synthese. Die Extraktion von Tβ4 aus Rinderthymus ist nicht nur kostspielig, sondern auch durch die Verfügbarkeit des Materials und die Extraktionstechniken begrenzt, was zu einer geringen Reinheit und einem niedrigen Gehalt führt. Das Vorhandensein von Verunreinigungen bringt auch viele Probleme mit sich, insbesondere in Anbetracht der zunehmenden Anzahl von Viren bei Rindern, was den Extraktionsprozess erschwert. Mit der Entwicklung der Gentechnik wird der Einsatz von gentechnischen Methoden zur Herstellung von Tβ4 eine neue Richtung einschlagen. In unserem Labor planen wir, eine Tandem-Expression von künstlich synthetisiertem Tβ4 in Pflanzen durchzuführen, um transgene Pflanzen mit effizienter Expression von Tβ4 zu erhalten. Im Vergleich zu natürlich gewonnenem Tβ4 hat das mit transgenen Pflanzen hergestellte Tβ4 die Vorteile einer höheren Bioaktivität, einer höheren Reinheit und weniger Nebenwirkungen. Darüber hinaus stellt es den optimalen Ansatz dar, um die Produktionskosten zu senken, Kontaminationen zu minimieren und eine Produktion im großen Maßstab zu ermöglichen.[3]
Hintergrund
Thymosin beta 4 ist ein aus 43 Aminosäureresten bestehendes Peptid mit einem isoelektrischen Punkt von 5,1 und ist in Säugetieren hoch konserviert. Es ist ein zytoplasmatisches Protein und kein Kernprotein, im Gegensatz zu Thymosin alpha oder ähnlichen Thymosinen. [2][3]Thymosin beta 4 ist an verschiedenen physiologischen Funktionen beteiligt, unter anderem an der Immunfunktion, der Entwicklung des Nervensystems, der Wundheilung und den Funktionen des Aktinproteins.
Im Gegensatz zu Thymosin alpha oder ähnlichen Thymosinen ist Thymosin beta 4 ein zytoplasmatisches Protein und kein Kernprotein. Es enthält weniger hydrophobe Aminosäuren und nicht die Lys-Lys-Xaa-Lys-Strukturregion. Chemische Konformationsstudien haben gezeigt, dass Thymosin beta 4 als eine einzige Kette existiert und funktioniert. Es hat eine interne Wiederholungsregion zwischen den Resten 31-43 und 18-30 mit sechs identischen Aminosäuren. Obwohl es zwischen den Resten 4-12 und 32-40 zwei stark helikale Regionen gibt, bildet Thymosin beta 4 keine Prolin-Wendung. Was die biologische Verteilung und Expression betrifft, so wurde Thymosin beta 4 ursprünglich aus dem Thymus gereinigt. Daher nahm man zunächst an, dass es sich um ein Thymushormon handelt, das auf die frühe Phase der T-Zell-Reifung wirkt. Thymosin beta 4 ist jedoch auch in anderen Geweben, Organen und Zellen weit verbreitet, wobei die höchsten Konzentrationen in Milz, Thymus, Lunge und Peritonealmakrophagen zu finden sind, gefolgt von Gehirn, Leber, Nieren, Hoden und Herz. Auch Zellen, die nicht zum retikuloendothelialen System gehören, wie Fibroblasten, können Thymosin beta 4 synthetisieren. Thymozyten weisen siebenmal höhere Mengen an Thymosin-beta-4-mRNA auf als thymische Stromazellen, und die Expression von Thymosin-beta-4 wird in verschiedenen Blutzelltypen beobachtet. Studien an der cDNA von Thymosin beta 4 haben gezeigt, dass ihr ein Signalpeptid fehlt.[1] Obwohl es auch sekretierte Proteine im Körper gibt, denen Signalpeptide fehlen, wie Interleukin-1 (IL-1) und endotheliale Wachstumsfaktoren, sind Experten der Ansicht, dass Thymosin beta 4 wahrscheinlich kein sekretiertes Protein ist und eher für bestimmte grundlegende Zellfunktionen notwendig ist.
Anmeldung
Grundlagen- und angewandte Forschung zur Optimierung der Funktion endothelialer Progenitorzellen mit Thymosin Beta 4 (Tβ4)
Die Häufigkeit und Sterblichkeit ischämischer Herz-Kreislauf-Erkrankungen nimmt von Jahr zu Jahr zu und stellt eine ernste Bedrohung für die menschliche Gesundheit dar. Die Pathogenese dieser Krankheiten ist hochkomplex, und die Dysfunktion der Endothelzellen spielt eine entscheidende Rolle bei der Entstehung ischämischer Herz-Kreislauf-Erkrankungen. Obwohl reife Endothelzellen Endothelschäden reparieren können, ist ihre Regenerationsfähigkeit begrenzt. Endotheliale Progenitorzellen (EPCs) sind eine Art Vorläuferzellen für vaskuläre Endothelzellen und haben das Potenzial, sich in Endothelzellen zu differenzieren. Zahlreiche Studien haben gezeigt, dass EPCs verschiedene Rollen bei der Gefäßreparatur und Neovaskularisierung spielen. Die klinische Anwendung der EPZ-Transplantation steht jedoch noch vor vielen Herausforderungen. Verschiedene kardiovaskuläre Erkrankungen oder Risikofaktoren wie Alterung, Bluthochdruck, Hypercholesterinämie und Diabetes können die Zahl der zirkulierenden EPZ verringern und ihre Funktion beeinträchtigen, was ihre Anwendung bei ischämischen kardiovaskulären Erkrankungen stark einschränkt. Daher ist die Verbesserung der Funktion von EPCs eine wichtige Strategie für die künftige EPC-Transplantationstherapie.[1][2]
Thymosin beta 4 (Tβ4), ein niedermolekulares Protein mit 43 Aminosäureresten, ist an der Vermittlung verschiedener biologischer Reaktionen wie Angiogenese, Wundheilung und Entzündungskontrolle beteiligt. Unsere frühere Forschung hat ergeben, dass Tβ4 die Proliferation und Migration von EPCs aus menschlichem peripheren Blut fördern kann, während es ihre Apoptose und Seneszenz hemmt. Tβ4 erhöht signifikant die angiogene Fähigkeit der EPCs und zeigt eine dosisabhängige Beziehung mit einem maximalen Effekt bei 1000 ng/mL (im Vergleich zur Kontrollgruppe, 33,33±1,86 vs 18,34±2,02, P<0,05). Die Western-Blot-Analyse zeigt, dass Tβ4 die Phosphorylierung von Akt Ser473 und eNOS Ser1177 fördert, wobei auch hier eine dosisabhängige Beziehung besteht. Akt siRNA und eNOS siRNA hemmen beide signifikant die pro-angiogenen Effekte von Tβ4 auf EPCs.
- Behandlung von Hautwunden
- Behandlung von kardiovaskulären und zerebrovaskulären Verletzungen
- Behandlung von Verletzungen des Auges
- Andere Anwendungen
Aufgrund seiner biologischen Funktionen, zu denen die Förderung der Migration von Endothelzellen, die Verhinderung der Zellapoptose, entzündungshemmende Wirkungen und die Förderung der Entwicklung von Haarfollikeln gehören, weist Tβ4 auch ein erhebliches Potenzial für die Hautpflege, die Bekämpfung der Hautalterung und die Förderung des Haarwachstums auf, neben anderen Aspekten der Gesundheitsfürsorge.

