KPV
KPV hat eine starke entzündungshemmende Wirkung auf das zentrale Nervensystem, den Magen-Darm-Trakt, die Lunge, das Gefäßsystem und die Gelenke.
$4.10
WhatsApp uns
◐ Großer Preis auf WhatsApp!
◐ MOQ: 10 Stück
◐ Anlage zur Herstellung von Peptiden
◐ Umsetzung der CGMP-Normen
◐ ISO9001 & ISO14000
DIESES TEILEN
Navigation für Produktinformationen
KPV-Struktur
- Sequenz:Lys-Pro-Val
- CAS-Nummer:67727-97-3
- Molekulare Formel:C16H30N4O4
- Molekulargewicht: 342,43 g/mol
Was ist KPV?
KPV ist ein C-terminales Peptidfragment des α-Melanozyten-stimulierenden Hormons (α-MSH). Es ist eines von mehreren kurzen Peptidderivaten von α-MSH, die getestet wurden, um festzustellen, ob sie ähnliche photoprotektive Eigenschaften, anti-ischämische Aktivität, sexuelle Effekte oder Vorteile für das Fressverhalten und die Energiehomöostase aufweisen.
KPV besteht aus Lysin-Prolin-Valin und hat erhebliche entzündungshemmende Eigenschaften, und das Peptid wird aktiv als potenzielle Therapie für entzündliche Darmerkrankungen untersucht. Es gibt Hinweise auf eine starke entzündungshemmende Wirkung im zentralen Nervensystem, im Magen-Darm-Trakt, in der Lunge, im Gefäßsystem und in den Gelenken. Da es sich bei KPV um ein kleines Peptid handelt, kann es auf verschiedene Weise verabreicht werden, z. B. oral, intravenös und transdermal.
KPV-Effekte
Entzündung des Darms
Das vielleicht wichtigste Ergebnis der KPV-Forschung ist, dass das Peptid die Darmentzündung reduziert. In einem Mausmodell für entzündliche Darmerkrankungen (IBD) zeigte KPV robuste Ergebnisse bei der Verringerung von Entzündungsinfiltraten, MPO-Aktivität und allgemeinen histologischen Anzeichen von Entzündungen, und die in der Studie mit KPV behandelten Mäuse erholten sich schneller und nahmen mehr Gewicht zu als Mäuse, die mit Placebo behandelt wurden.
Weitere Studien zum Mechanismus der KPV-Verabreichung haben gezeigt, dass die Beladung von mit Hyaluronsäure funktionalisierten Nanopartikeln mit KPV dazu beiträgt, die entzündungsfördernde Wirkung des Peptids an die entsprechenden Stellen im Darm zu lenken. In Mausmodellen beschleunigt dies die Heilung der Schleimhäute und reduziert die Entzündung durch eine starke Senkung des TNF-α-Spiegels. In vielerlei Hinsicht ist KPV ein wirksamerer und gezielterer Ansatz zur Verringerung der IBD-Entzündung, ohne TNF-α an anderer Stelle im Körper zu beeinflussen. Die Modifizierung von KPV hat den Vorteil, dass die orale Bioverfügbarkeit des Peptids erhöht wird. Dies erhöht zwar nicht die Wirksamkeit des Peptids, aber es wirkt sich auf die Potenz und die Gesamtdosis aus, die zur Erzielung der Wirkung erforderlich ist.
KPV scheint nur in Fällen übermäßiger Entzündungen wirksam zu sein. Auf normales Gewebe hat es wenig bis keine Wirkung. Dies ist zumindest teilweise darauf zurückzuführen, dass KPV über Transportproteine in die Dickdarmzellen gelangt, die in Entzündungssituationen nicht reguliert werden. Dies deutet darauf hin, dass KPV ein wirksames Prophylaxe- oder Erhaltungsmedikament für CED sein könnte. Es kann auch während der Ruhephase eingenommen werden, da es keine Wirkung hat. Prof. Didier Merlin, der eine Reihe von Studien über die potenziellen gastrointestinalen Vorteile von KPV durchgeführt hat, entdeckte kürzlich, dass das Peptid über PepT1 in die Darmzellen gelangt, einen Proteinkanal, der im Darm nur bei Entzündungen in nennenswerter Menge vorhanden ist. Dies erklärt, warum KPV in einer bereits entzündeten Umgebung wirksamer ist. Es deutet auch auf eine neue Art der Medikamentenverabreichung hin, die bei einer Vielzahl von Erkrankungen angewendet werden kann. Durch die Ausrichtung auf Proteine, die bei Krankheiten verändert sind, auch wenn sie nicht direkt krankheitsverursachend sind, ist es möglich, die Wirkung eines Medikaments auf bestimmte Regionen zu konzentrieren. Auf diese Weise könnte die Dosierung von Medikamenten mit schwerwiegenden Nebenwirkungen verringert werden, und es könnten Medikamente entwickelt werden, die zwar für sich genommen nicht wirksam sind, aber im richtigen Krankheitsstadium eine starke therapeutische Wirkung haben.
KPV als allgemeiner Entzündungshemmer
Bereits 1984 zeigten Studien an Kaninchen, dass KPV ein starkes entzündungshemmendes und fiebersenkendes Mittel ist. In diesem Fall war KPV jedoch weniger wirksam als das intakte α-MSH-Molekül. Dies deutete für die damaligen Wissenschaftler darauf hin, dass KPV bestimmte Teile des α-MSH-Moleküls fehlten, die für eine volle fiebersenkende Wirkung erforderlich sind [5]. Es folgten Jahrzehnte der Forschung an verschiedenen modifizierten Formen von α-MSH.
Die vielleicht wichtigste Erkenntnis aus diesen Tests ist, dass sowohl α-MSH als auch mehrere seiner Analoga die Entzündung bei einer Vielzahl von Krankheiten verringern. Bislang wurden diese Moleküle bei Fieber, reizender und allergischer Kontaktdermatitis, Vaskulitis, Fibrose, Arthritis und Entzündungen der Augen, des Gehirns, der Lunge und des Magen-Darm-Trakts getestet. In allen Fällen ist alpha-MSH das wirksamste entzündungshemmende Mittel. Leider hat es eine wichtige Nebenwirkung - es verursacht Hautpigmentierung. Bei KPV hingegen gibt es diese Nebenwirkung nicht. Obwohl KPV nicht so wirksam ist wie intaktes α-MSH, bedeutet das Fehlen von Nebenwirkungen, dass es theoretisch möglich ist, den Spiegel zu erhöhen, um in den meisten Fällen die gewünschte Zielwirkung zu erzielen.
Es hat sich gezeigt, dass die Unterschiede in der Wirksamkeit bestenfalls minimal sind, da die meisten entzündungshemmenden Wirkungen von α-MSH auf die KPV-Fraktion zurückzuführen sind. Interessanterweise scheint das Ausgangsmolekül jedoch eher in der Lage zu sein, späte Entzündungsreaktionen zu hemmen. Bei Kontaktdermatitis beispielsweise verhindert α-MSH allergische Entzündungsreaktionen bis zu zwei Wochen nach der ersten Exposition besser. Dies deutet darauf hin, dass α-MSH möglicherweise einen Aspekt der Immunregulation beeinflusst, der nicht mit der unmittelbaren Entzündungsreaktion zusammenhängt [7]. Welcher Prozess dies ist, wird noch ermittelt.
Diese Abbildung zeigt die Schwellung der Ohren aufgrund von Kontaktdermatitis nach 24 Stunden (links) und 2 Wochen (rechts). Man beachte, dass die gleichzeitige Verabreichung von KPV mit dem Reizstoff nach 24 Stunden fast genauso wirksam ist wie die gleichzeitige Verabreichung von α-MSH mit dem Reizstoff. Nach 2 Wochen jedoch führte die Exposition gegenüber dem Reizstoff ohne gleichzeitige Verabreichung des Peptids zu einer wesentlich geringeren Schwellung von α-MSH im Vergleich zu KPV.
Wundheilung
Die Wundheilung ist ein komplexer physiologischer Prozess. Wissenschaftler haben drei allgemeine Phasen des Wundheilungsprozesses identifiziert: Entzündung, Proliferation und Remodellierung. Jede Phase ist durch Unterschiede in den Zellpopulationen und Zytokinkonzentrationen gekennzeichnet und stellt ein einzigartiges chemisches/physiologisches Umfeld für potenzielle Interventionen dar. Studien haben gezeigt, dass, obwohl jede Phase des Wundheilungsprozesses durch unterschiedliche Hautzell-Subtypen gekennzeichnet ist, die Mehrheit der Zellen den Melanocortin-1-Rezeptor (MC1R) exprimiert, der das α-Melanozyten-stimulierende Hormon bindet. Das bedeutet natürlich auch, dass diese Zelltypen auch α-MSH-Analoga wie KPV und KdPT binden.
Da diese α-MSH-Derivate einige der Eigenschaften von α-MSH beibehalten, andere jedoch nicht, sind sie für die Wundheilung potenziell nützlich. So verfügt KPV über die entzündungsfördernden Eigenschaften von α-MSH, aber nicht über die pigmentinduzierende Wirkung seines Stammpeptids. Damit ist KPV ein guter Kandidat für die Verbesserung der Wundheilung bei gleichzeitiger Vermeidung der charakteristischen Hautveränderungen, die normalerweise mit der natürlichen Narbenbildung einhergehen (ein Phänomen, von dem dunkelhäutige Menschen unverhältnismäßig stark betroffen sind).
Einer der Gründe für die entzündungshemmende Wirkung von KPV ist seine Beteiligung an der angeborenen Immunreaktion gegen zwei häufige Hauterreger. Studien haben gezeigt, dass KPV das Wachstum von Staphylococcus aureus und Candida albicans hemmt. Diese Vorteile treten bereits bei physiologischen Konzentrationen auf, was bedeutet, dass KPV eine wirksame Möglichkeit zur Verhinderung von Infektionen bei schweren Wunden, wie z. B. Verbrennungen, bieten kann - im Gegensatz zu anderen entzündungshemmenden Medikamenten, die die Fähigkeit des Körpers zur Infektionsbekämpfung hemmen. KPV kombiniert also entzündungshemmende Wirkung mit antimikrobieller Aktivität.
KPV ist ein strukturelles Modell für neuere Studien, die darauf abzielen, die antimykotische Wirkung von Peptiden in neuen Therapeutika zu reproduzieren. Die Idee ist, dass die 3D-Struktur von KPV es zu einem wirksamen Antimykotikum macht. Die Nachbildung dieser Struktur könnte es den Forschern ermöglichen, Verbindungen zu entwickeln, die dieselbe antimykotische Aktivität, aber unterschiedliche Auswirkungen auf andere biologische Prozesse haben.
Narbenbildung
Ausgehend von den bekannten Vorteilen von KPV in der ersten Phase der Wundheilung (Entzündung) wurde in der Studie auch seine Rolle in den beiden anderen Phasen der Wundheilung untersucht.KPV scheint die chronische Entzündung zu verringern, die zur Bildung hypertropher Narben (z. B. Vernarbung) führt. Diese Art der Narbenbildung ist durch eine ausgedehnte Makrophageninfiltration, TNF-Immunreaktivität und eine große Anzahl von Neutrophilen gekennzeichnet. Die Verwendung von α-MSH in diesem Zusammenhang führt zu kleineren Narben und einer weniger dramatischen Entzündungsreaktion. Ähnliche Wirkungen wurden in anderen Geweben wie der Lunge und dem Herzen festgestellt. Diese Ergebnisse geben Anlass zur Hoffnung, dass KPV eingesetzt werden kann, um die bei bestimmten Chemotherapeutika auftretende Narbenbildung zu verhindern, was nicht nur die Nebenwirkungen von Krebsbehandlungen verringert, sondern auch die Konzentration dieser Medikamente erhöht und damit die Wirksamkeit von Krebsbehandlungen verbessert.
Referenzierte Zitate
- M. E. Hiltz und J. M. Lipton, "Antiinflammatory activity of a COOH-terminal fragment of the neuropeptide alpha-MSH," FASEB J. Off. Publ. Fed. Am. Soc. Exp. Biol.Bd. 3, Nr. 11, S. 2282-2284, Sep. 1989.
- K. Kannengiesser et al.Melanocortin-abgeleitetes Tripeptid KPV hat entzündungshemmendes Potenzial in Mausmodellen für entzündliche Darmerkrankungen,". Inflamm. Bowel Dis., vol. 14, no. 3, pp. 324-331, Mar. 2008, doi: 10.1002/ibd.20334.
- B. Xiao et al.Die gezielte orale Verabreichung des Tripeptids KPV über Hyaluronsäure-funktionalisierte Nanopartikel lindert effizient die Colitis ulcerosa". Mol. Ther. J. Am. Soc. Gene Ther., vol. 25, no. 7, pp. 1628-1640, 05 2017, doi: 10.1016/j.ymthe.2016.11.020.
- G. Dalmasso, L. Charrier-Hisamuddin, H. T. T. Nguyen, Y. Yan, S. Sitaraman und D. Merlin, "PepT1-Mediated Tripeptide KPV Uptake Reduces Intestinal Inflammation,". Gastroenterologie, vol. 134, no. 1, pp. 166-178, Jan. 2008, doi: 10.1053/j.gastro.2007.10.026.
- D. B. Richards und J. M. Lipton, "Wirkung von alpha-MSH 11-13 (Lysin-Prolin-Valin) auf Fieber beim Kaninchen," Peptide, vol. 5, no. 4, pp. 815-817, Aug. 1984, doi: 10.1016/0196-9781(84)90027-5.
- T. Brzoska, T. A. Luger, C. Maaser, C. Abels und M. Böhm, "Alpha-Melanozyten-stimulierendes Hormon und verwandte Tripeptide: Biochemie, entzündungshemmende und schützende Wirkungen in vitro und in vivo sowie Zukunftsperspektiven für die Behandlung immunvermittelter Entzündungskrankheiten". Endocr. Rev., vol. 29, no. 5, pp. 581-602, Aug. 2008, doi: 10.1210/er.2007-0027.
- T. A. Luger und T. Brzoska, "α-MSH-verwandte Peptide: eine neue Klasse von entzündungshemmenden und immunmodulierenden Arzneimitteln," Ann. Rheum. Dis., vol. 66, no. Suppl 3, pp. iii52-iii55, Nov. 2007, doi: 10.1136/ard.2007.079780.
- M. Cutuli, S. Cristiani, J. M. Lipton und A. Catania, "Antimikrobielle Wirkungen von alpha-MSH-Peptiden". J. Leukoc. Biol., Bd. 67, Nr. 2, S. 233-239, Feb. 2000, doi: 10.1002/jlb.67.2.233.
- M. F. Masman et al.Synthese und Konformationsanalyse von His-Phe-Arg-Trp-NH2 und Analoga mit antimykotischen Eigenschaften,". Bioorg. Med. Chem., Bd. 14, Nr. 22, S. 7604-7614, Nov. 2006, doi: 10.1016/j.bmc.2006.07.007.
- K. S. de Souza et al.Verbesserte Wundheilung der Haut nach intraperitonealer Injektion von alpha-Melanozyten-stimulierendem Hormon". Exp. Dermatol., vol. 24, no. 3, pp. 198-203, Mar. 2015, doi: 10.1111/exd.12609.
- C. Lonati et al.Modulierende Effekte von NDP-MSH in der sich regenerierenden Leber nach teilweiser Hepatektomie bei Ratten,". Peptide, vol. 50, pp. 145-152, Dec. 2013, doi: 10.1016/j.peptides.2013.10.014.
- G. Colombo et al.Genexpressionsprofilierung zeigt mehrfache schützende Einflüsse des Peptids Alpha-Melanozyten-stimulierendes Hormon bei experimenteller Herztransplantation". J. Immunol. Baltim. Md 1950, vol. 175, no. 5, pp. 3391-3401, Sep. 2005, doi: 10.4049/jimmunol.175.5.3391.
- G. Colombo et al.Produktion und Wirkungen des alpha-Melanozyten-stimulierenden Hormons bei akuter Lungenverletzung". Schock Augusta Ga, vol. 27, no. 3, pp. 326-333, Mar. 2007, doi: 10.1097/01.shk.0000239764.80033.7e.
- M. Schiller et al.Human Dermal Fibroblasts Express Prohormone Convertases 1 and 2 and Produce Proopiomelanocortin-Derived Peptides," J. Invest. Dermatol., vol. 117, no. 2, pp. 227-235, Aug. 2001, doi: 10.1046/j.0022-202x.2001.01412.x.
- T. Brzoska, M. Böhm, A. Lügering, K. Loser, und T. A. Luger, "Terminal signal: anti-inflammatory effects of α-melanocyte-stimulating hormone related peptides beyond the pharmacophore," Adv. Exp. Med. Biol., Bd. 681, S. 107-116, 2010, doi: 10.1007/978-1-4419-6354-3_8.
- S. J. Getting, H. B. Schiöth und M. Perretti, "Dissection of the anti-inflammatory effect of the core and C-terminal (KPV) alpha-melanocyte-stimulating hormone peptides," J. Pharmacol. Exp. Ther., Bd. 306, Nr. 2, S. 631-637, Aug. 2003, doi: 10.1124/jpet.103.051623.
- K. Pawar, C. S. Kolli, V. K. Rangari und R. J. Babu, "Transdermal Iontophoretic Delivery of Lysine-Proline-Valine (KPV) Peptide Across Microporated Human Skin," J. Pharm. Sci., vol. 106, no. 7, pp. 1814-1820, Jul. 2017, doi: 10.1016/j.xphs.2017.03.017.
ALLE ARTIKEL UND PRODUKTINFORMATIONEN AUF DIESER WEBSITE DIENEN NUR ZU INFORMATIONS- UND BILDUNGSZWECKEN.
In keiner Weise unterstützt oder befürwortet dieser Arzt/Wissenschaftler den Kauf, den Verkauf oder die Verwendung dieses Produkts aus irgendeinem Grund. MOL Changes hat keine Verbindung oder Beziehung, implizit oder anderweitig, mit diesem Arzt. Der Zweck der Nennung dieses Arztes ist es, die erschöpfende Forschungs- und Entwicklungsarbeit der Wissenschaftler, die an diesem Peptid arbeiten, anzuerkennen, zu würdigen und zu empfehlen.
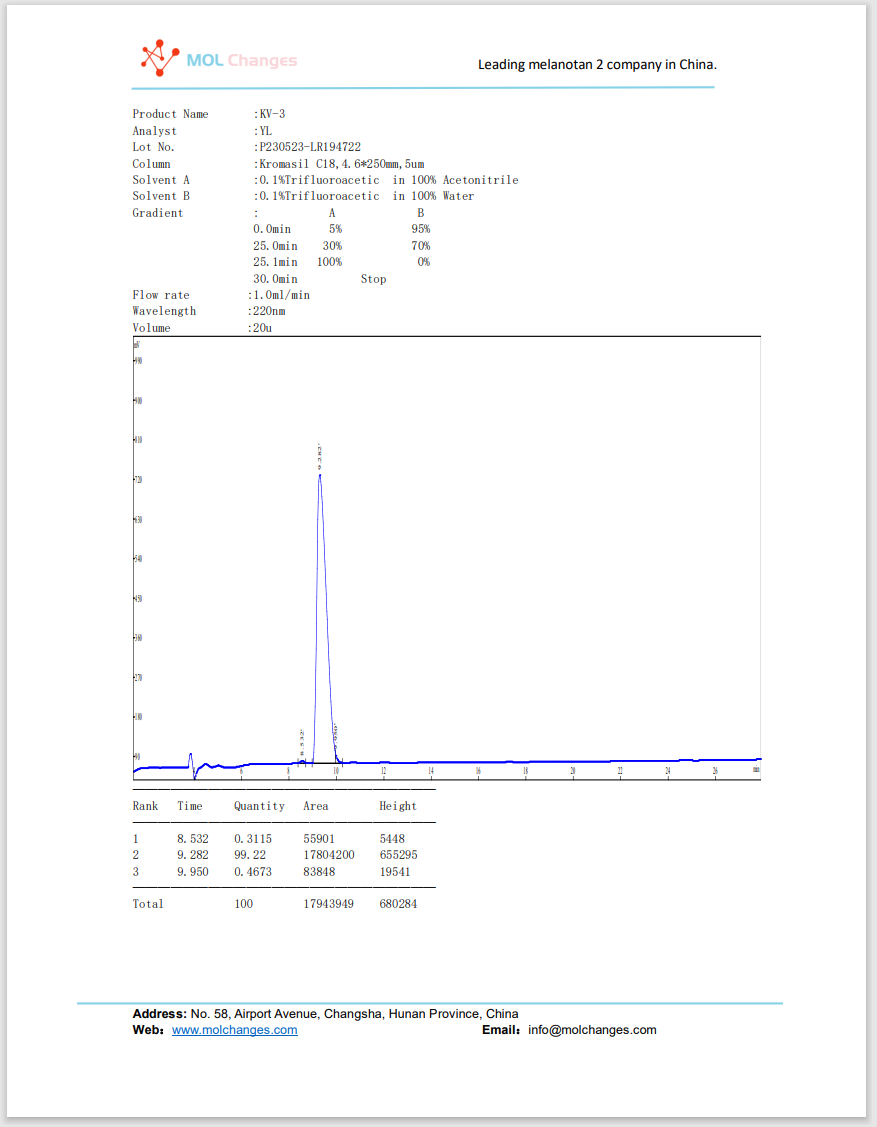
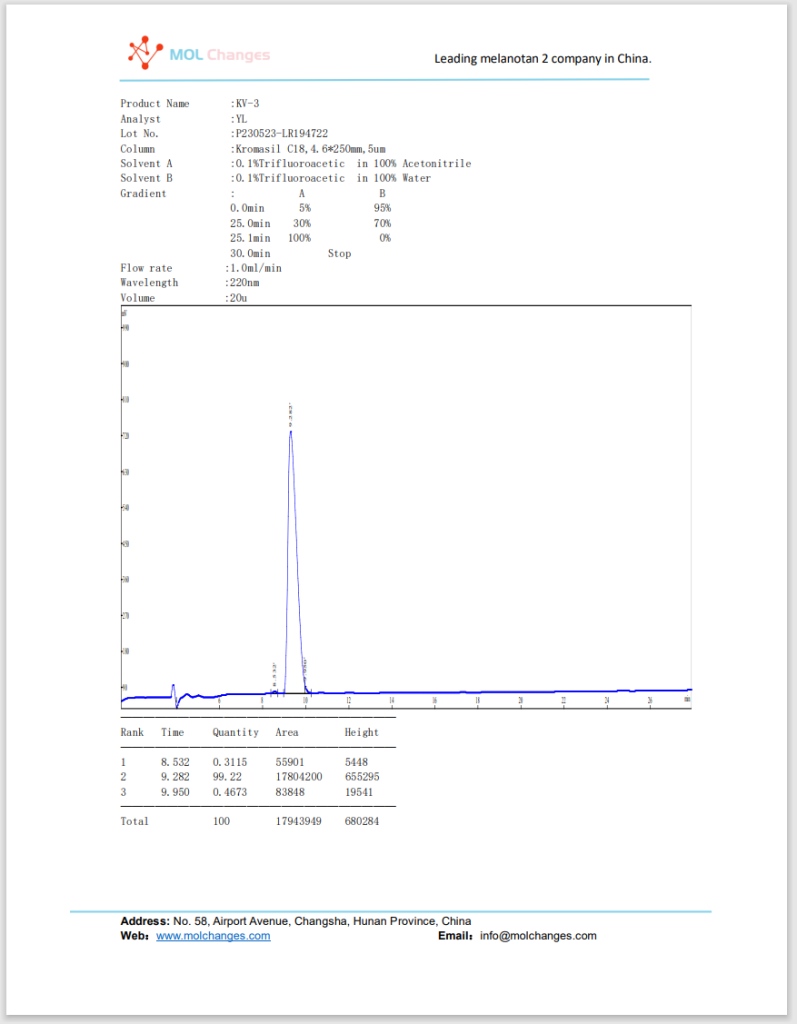
HPLC-Testbericht
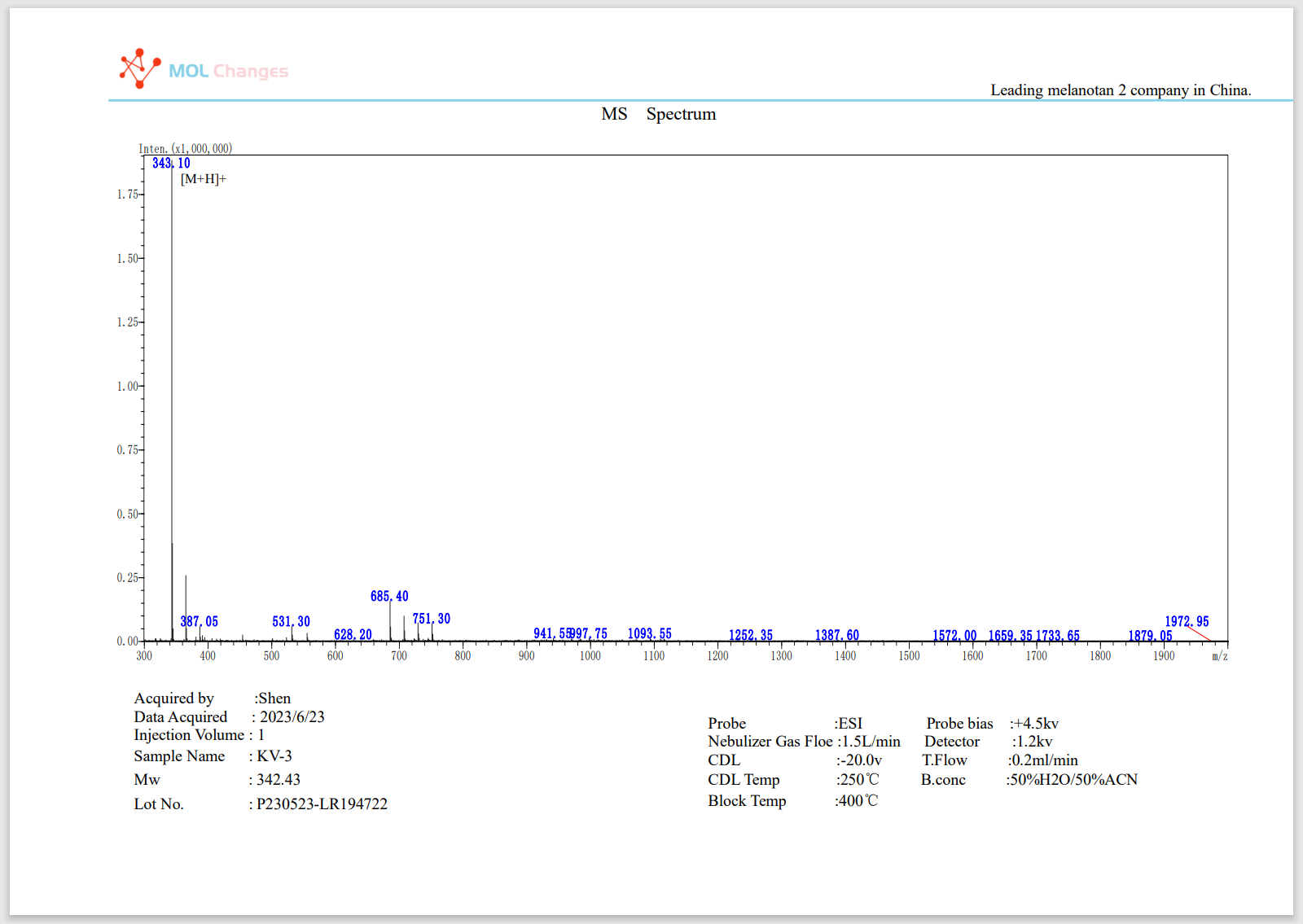
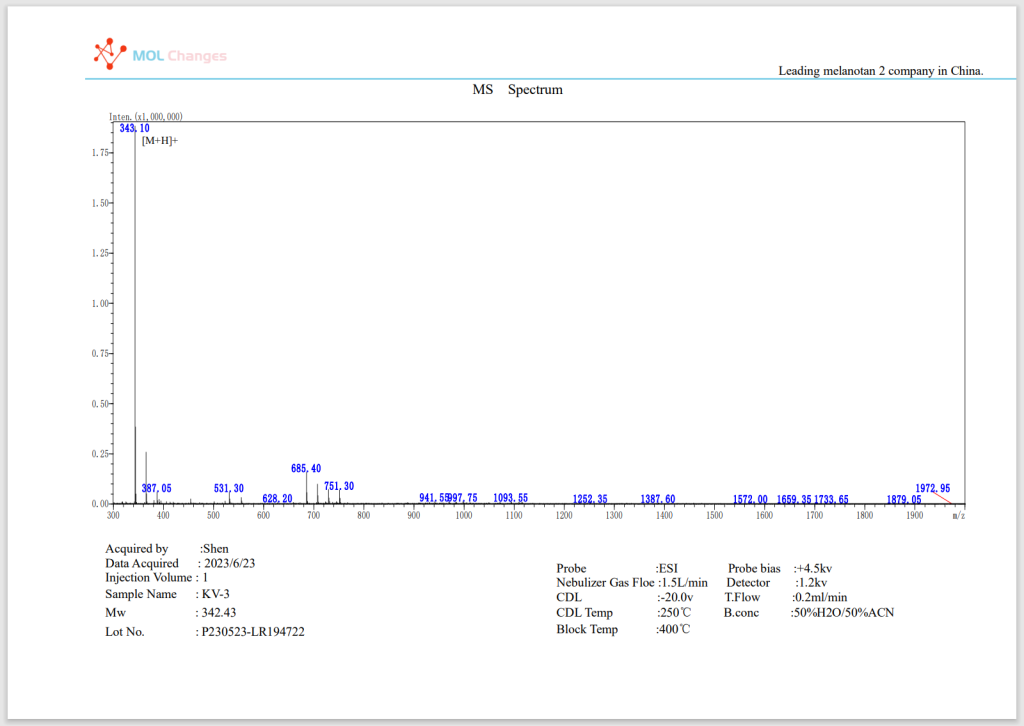
MS-Testbericht
Hersteller-Informationen
- KPV wird von der Firma MOL Changes hergestellt.
- KPV-Lieferant MOL Änderungen.
- Höchstzulässige Produktionsmenge: 100000 Flaschen.
- Inhaltsstandard: Netto-Peptid.
- Reinheit: ≥98% für alle Produkte.
- Anpassung: 1mg-1g Größe Anpassung ist akzeptabel