Overview
Thymosin beta 4 (Tβ4) is a small-molecule protein composed of multiple amino acid residues and is widely distributed in various tissues and cells of the human body.[1][2] As one of the main actin-regulating molecules in the human body, it has multiple biological functions and plays a crucial role in tissue regeneration, remodeling, wound healing, maintenance of actin balance, tumor development and metastasis, cell apoptosis, inflammation, angiogenesis, hair follicle development, and other physiological and pathological processes.
Biological Functions and Mechanisms of Action
Tβ4 is one of the main actin-regulating molecules in the human body and has multiple biological functions, playing a significant role in tissue regeneration, remodeling, wound healing, maintenance of actin balance, tumor development and metastasis, cell apoptosis, inflammation, angiogenesis, hair follicle development, and other physiological and pathological processes.
Source: Tandfonline
- Actin-regulating factor: Actin accounts for about 10% of the total protein in non-muscle cells and is an essential component required for cell structure, cell movement, and wound healing. The presence of Tβ4 in cells is sufficient to sequester all actin monomers and participate in regulating actin polymerization and depolymerization. Tβ4 can bind to actin monomers in a 1:1 ratio, preventing the formation of F-actin polymers. The binding of Tβ4 to actin is accompanied by the dissociation of bound water. The C-terminal of Tβ4 binds to actin His-40, causing a conformational change in actin monomers. The Tβ4 molecule contains an actin-binding domain (LKKTET), which is the main electrostatic contact site. Its N-terminal fragment can inhibit actin polymerization through steric hindrance. When acting alone, Tβ4 can inhibit actin polymerization and nucleotide exchange on actin. This is in contrast to the role of another actin-binding protein, Profilin, which promotes the exchange of ADP and ATP, accelerating actin assembly. [1][2]Tβ4 and Profilin can synergistically regulate actin assembly. Tβ4 can regulate the conversion between G-actin and F-actin. It has been reported that the concentration of Tβ4 reaches 300 pmol in highly mobile blood cells, while the concentration required for Tβ4 to bind to G-actin is less than 20 pmol. With an increase in concentration, Tβ4 reduces the depolymerization ability of F-actin. This may be the reason why Tβ4 regulates the function of the cellular microfilament system.
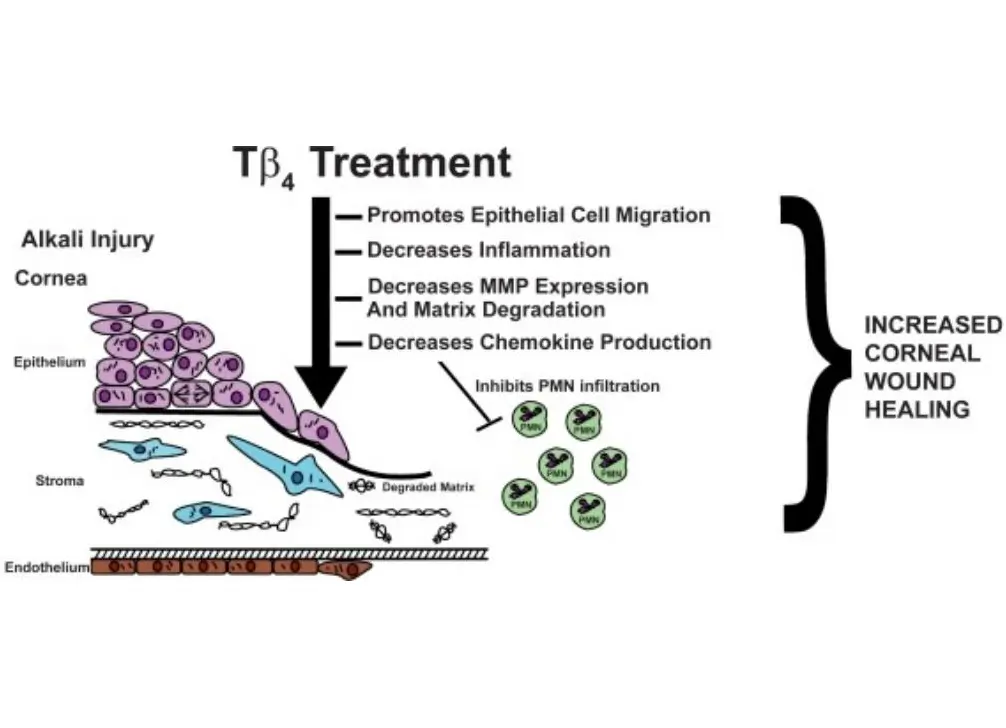
Promotion of endothelial cell migration and angiogenesis: Studies using the chicken chorioallantoic membrane (CAM) angiogenesis model have shown that when endothelial cells differentiate into tubular structures, the mRNA content of Tβ4 increases by fivefold, and transfection with Tβ4 accelerates the formation of tube-like structures in endothelial cell clones. Additionally, research has found that Tβ4 can interact with fibrin and collagen mediated by transglutaminase (Factor XIIIa) and play an important role in the process of blood clotting. Furthermore, in a full-thickness skin injury experiment in aging diabetic mice, Tβ4 can accelerate the healing of large-area skin wounds and deep burns, promote skin and corneal repair, and demonstrate the ability to accelerate wound healing.
Inhibition of cell apoptosis: Tβ4 has a significant protective effect on corneal epithelial cells damaged by corrosive substances such as benzalkonium chloride or ethanol. Upregulation of Tβ4 gene expression is beneficial for enhancing the hypoxia resistance of cells.[2][3]
Downregulation of key inflammatory molecules: Wound healing is a complex biological process that can be divided into three distinct stages: inflammation, cell proliferation, and tissue remodeling, with the gene expression of relevant proteins being upregulated and then downregulated in each stage. For chronic wounds, this regulatory process can be disrupted by factors such as age, underlying diseases, and immunosuppressive drugs, leading to excessive production of inflammatory molecules, excessive inflammation, and hindered cell proliferation and tissue remodeling. Research has found that Tβ4 can reduce levels of free radicals, slow down lipid peroxidation, inhibit the production of inflammatory cytokines such as IL-1, macrophage inflammatory protein 1α (MIP1α), MIP1β, monocyte chemotactic protein-1 (MCP-1), decrease levels of thromboxane and prostaglandin 2α, thereby alleviating inflammation. Therefore, it can be used for the treatment of inflammatory disorders such as segmental enteritis and muscle atrophy.
Stimulation of adult epicardial stem cell differentiation: Tβ4 plays a crucial role in various aspects of coronary vessel development and can significantly stimulate the growth of quiescent adult mouse epicardial grafts, restoring the multipotency of fibroblasts, smooth muscle cells, and endothelial cells, and inducing their differentiation.[1][2] Knockout of the Tβ4 gene in the heart leads to a significant decrease in the levels of the angiogenic cleavage product of Tβ4 (AcSDKP). Although injection of AcSDKP cannot restore the heart, it can significantly enhance the differentiation of adult mouse epicardial progenitor cells into endothelial cells. This suggests that Tβ4 and AcSDKP are potent stimulators of coronary and neovascularization, and Tβ4-induced adult mouse epicardial cells can serve as a source of vascular regeneration, leading to sustained regeneration of the compromised vasculature at a low level after cardiac injury.
Stimulation of hair follicle development: Tβ4 promotes the migration, differentiation, and extracellular matrix reconstruction of hair follicle stem cells, thereby regulating hair growth. Studies in rats and mice have found that during the hair growth cycle, a specific subset of hair follicle keratinocytes originating from the bulge region highly co-express Tβ4, while skin stem cells are also present in the bulge of the hair follicle. When Tβ4 concentration is at the nanomolar level, the migration and differentiation of stem cells are enhanced, and the presence of Tβ4 also increases the expression and secretion of matrix metalloproteinase-2 (MMP-2), an extracellular matrix-degrading enzyme.
Relationship with tumor formation: Upregulation of the Tβ4 gene has been observed in various tumor cells, including medullary thyroid carcinoma, colorectal cancer, highly malignant melanoma, breast cancer, and oral squamous cell carcinoma. Tβ4 can effectively induce the expression of vascular endothelial growth factor, promoting angiogenesis and activating cell migratory properties, leading to tumor malignancy. Upregulation of Tβ4 expression results in downregulation of E-cadherin expression, weakening cell adhesion, and increased expression of matrix metalloproteinases, providing growth advantage and invasive characteristics to cancer cells, thus contributing to malignancy. Tβ4 possesses anti-apoptotic capabilities, and increased expression of Tβ4 can reduce the extent of cell apoptosis, possibly due to Tβ4 inhibiting the release of cytochrome c and disrupting the initiation of the apoptosis process, which is another important characteristic of malignant tumors.
Promotion of corneal repair: Thymosin β4 has demonstrated its ability to promote wound healing in various corneal injury models and regulate the production of certain key cytokines. Research has found that thymosin β4 can reduce the expression of matrix metalloproteinases, promote extracellular matrix remodeling, and activate cytokines. Specifically, it inhibits the activity of matrix metalloproteinases, contrary to the conclusion drawn from thymosin β4-treated skin injury models. [1][2][3]This suggests that the regulatory pathways of specific enzymes in the tissue repair process can be either upregulated or downregulated.
Preparation Method
Currently, there are two main sources of thymosin beta 4 (Tβ4) used in clinical and research settings: extraction from bovine thymus and chemical synthesis. Extracting Tβ4 from bovine thymus is not only costly but also limited by material availability and extraction techniques, resulting in low purity and low content. The presence of impurities also brings many issues, especially considering the increasing number of viruses in cattle, which complicates the extraction process. With the development of genetic engineering, utilizing genetic engineering methods to produce Tβ4 will become a new direction. In our laboratory, we plan to perform tandem expression of artificially synthesized Tβ4 in plants to obtain transgenic plants with efficient expression of Tβ4. Compared to naturally extracted Tβ4, Tβ4 produced using transgenic plants has the advantages of higher bioactivity, higher purity, and fewer side effects. Additionally, it represents the optimal approach for reducing production costs, minimizing contamination, and enabling large-scale production.[3]
Background
Thymosin beta 4 is a peptide composed of 43 amino acid residues with an isoelectric point of 5.1 and is highly conserved in mammals. It is a cytoplasmic protein rather than a nuclear protein, unlike thymosin alpha or similar thymosins. [2][3]Thymosin beta 4 is involved in various physiological functions, including immune function, nervous system development, wound healing, and actin protein functions.
Unlike thymosin alpha or similar thymosins, thymosin beta 4 is a cytoplasmic protein rather than a nuclear protein. It contains fewer hydrophobic amino acids and does not contain the Lys-Lys-Xaa-Lys structural region. Chemical conformation studies have shown that thymosin beta 4 exists and functions as a single chain. It has an internal repeat region between residues 31-43 and 18-30, with six identical amino acids. Although there are two highly helical regions between residues 4-12 and 32-40, thymosin beta 4 does not form a proline turn. In terms of biological distribution and expression, thymosin beta 4 was initially purified from the thymus. Therefore, it was initially believed to be a thymic hormone acting on early-stage T-cell maturation. However, thymosin beta 4 is widely present in other tissues, organs, and cells, with the highest levels found in the spleen, thymus, lungs, and peritoneal macrophages, followed by the brain, liver, kidneys, testes, and heart. Even non-reticuloendothelial system cells such as fibroblasts can synthesize thymosin beta 4. Thymocytes have seven times higher levels of thymosin beta 4 mRNA than thymic stromal cells, and thymosin beta 4 expression is observed in various blood cell types. Studies on thymosin beta 4 cDNA have shown that it lacks a signal peptide.[1] Although there are also secreted proteins in the body that lack signal peptides, such as interleukin-1 (IL-1) and endothelial growth factors, experts still believe that thymosin beta 4 is unlikely to be a secreted protein and is more likely to be essential for certain basic cellular functions.
Application
Basic and Applied Research on Optimizing Endothelial Progenitor Cell Function with Thymosin Beta 4 (Tβ4)
The incidence and mortality rates of ischemic cardiovascular diseases have been increasing year by year, posing a serious threat to human health. The pathogenesis of these diseases is highly complex, and endothelial cell dysfunction plays a crucial role in the development of ischemic cardiovascular diseases. Although mature endothelial cells can repair endothelial damage, their regenerative capacity is limited. Endothelial progenitor cells (EPCs) are a type of precursor cell for vascular endothelial cells and have the potential to differentiate into endothelial cells. Numerous studies have shown that EPCs play various roles in vascular repair and neovascularization. However, the clinical application of EPC transplantation still faces many challenges. Several cardiovascular diseases or risk factors such as aging, hypertension, hypercholesterolemia, and diabetes can decrease the number of circulating EPCs and impair their function, greatly limiting their application in ischemic cardiovascular diseases. Therefore, improving the function of EPCs will be an important strategy for future EPC transplantation therapy.[1][2]
Thymosin beta 4 (Tβ4), a low-molecular-weight protein composed of 43 amino acid residues, is involved in mediating various biological responses such as angiogenesis, wound healing, and inflammation control. Our previous research has found that Tβ4 can enhance the proliferation and migration of human peripheral blood EPCs while inhibiting their apoptosis and senescence. Tβ4 significantly increases the angiogenic ability of EPCs, showing a dose-dependent relationship with a maximum effect at 1000 ng/mL (compared to the control group, 33.33±1.86 vs 18.34±2.02, P<0.05). Western blot analysis shows that Tβ4 promotes the phosphorylation of Akt Ser473 and eNOS Ser1177, also exhibiting a dose-dependent relationship. Akt siRNA and eNOS siRNA both significantly inhibit the pro-angiogenic effects of Tβ4 on EPCs.
- Treatment of skin wounds
- Treatment of cardiovascular and cerebrovascular injuries
- Treatment of ophthalmic injuries
- Other applications
Due to its biological functions, including promoting endothelial cell migration, preventing cell apoptosis, anti-inflammatory effects, and promoting hair follicle development, Tβ4 also demonstrates significant potential in skincare, combating skin aging, and promoting hair regrowth, among other aspects of healthcare.