多肽修饰
多肽糖基化
什么是肽糖基化?
肽糖基化是将碳水化合物分子(聚糖)共价连接到肽或蛋白质上,形成糖肽或糖蛋白。这一过程主要通过以下方式进行:
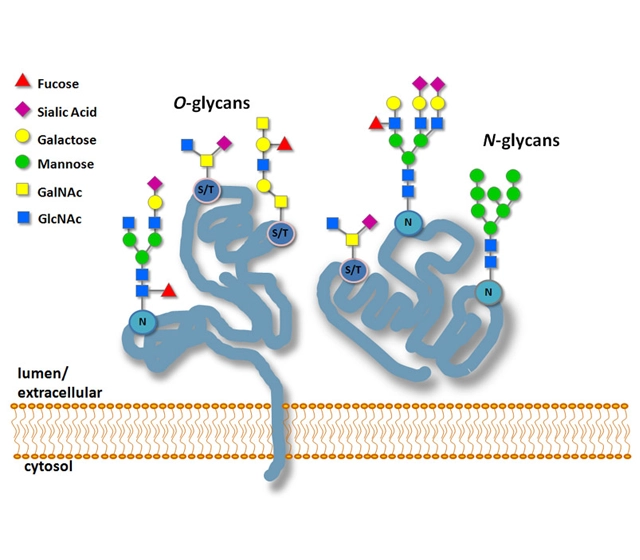
N-连接的糖基化:聚糖与天冬酰胺(Asn)残基结合,序列为 Asn-X-Ser/Thr(X≠Pro)。
O-连接糖基化:聚糖连接到丝氨酸(Ser)或苏氨酸(Thr)残基上。
功能:增强蛋白质的稳定性,帮助正确折叠,促进细胞间的交流,并在免疫反应和疾病机制(如癌症生物标志物)中发挥作用。
它通常存在于真核生物和一些细菌中,是生物过程和生物制药应用(如抗体药物)所必需的。
常见的糖基化氨基酸
连接糖基化
N-连接的糖基化更为常见,而O-连接的糖基化则更为多样,通常发生在Ser、Thr和/或Asn的侧链上,但其他氨基酸也可能被糖基化。
|
糖
|
氨基酸
|
糖化氨基酸
|
|---|---|---|
|
α-D-半乳糖 |
丝氨酸 |
丝氨酸(alpha-D-GalNAc) |
|
α-D-半乳糖 |
苏氨酸 |
Thr(alpha-D-GalNAc) |
|
β-D-半乳糖 |
丝氨酸 |
Ser(beta-D-GalNAc) |
|
β-D-半乳糖 |
苏氨酸 |
Thr(beta-D-GalNAc) |
|
β-D-半乳糖 |
丝氨酸 |
Ser(Gal-beta(1-3)GalNAc) |
|
β-D-葡萄糖 |
丝氨酸 |
丝氨酸(beta-D-GlcNAc) |
|
β-D-葡萄糖 |
苏氨酸 |
Thr(beta-D-GlcNAc) |
|
β-D-葡萄糖 |
天门冬酰胺 |
Asn(beta-D-GlcNAc) |
|
β-D-葡萄糖 |
丝氨酸 |
丝氨酸(beta-D-谷氨酰) |
|
α-D-甘露糖 |
丝氨酸 |
Thr(甲型-D-锰) |
|
α-D-甘露糖 |
天门冬酰胺 |
Asn(α-D-锰) |
|
α-D-甘露糖 |
丝氨酸 |
丝氨酸(α-D-锰) |
|
α-D-甘露糖 |
苏氨酸 |
Thr(甲型-D-锰) |
特色引文
n-Gluc-Lys([Al18 F]NOTA)-TOCA 的制备和初步生物学评价
奥曲肽及其衍生物能特异性地与体生长激素受体(SSTR)结合,而SSTR通常在许多肿瘤细胞上过度表达。因此,18F 标记的奥曲肽及其衍生物可用于 SSTR 阳性肿瘤的诊断和疗效评估。为了探索一种用于诊断SSTR阳性肿瘤的新型PET探针,我们利用n-Gluc-Lys([Al18F]NOTA)-TOCA与Al18F分子的螯合反应,快速高效地合成了n-Gluc-Lys([Al18F]NOTA)-TOCA、n-Gluc-Lys([Al18F]NOTA)-TOCA是一种糖基化的奥曲肽衍生物,与1,4,7-三氮杂环壬烷-1,4,7-三乙酸(NOTA)结合在一起。n-Gluc-Lys([Al18F]NOTA)-TOCA 的标记效率为 69%,总合成时间为 25-30 分钟。经 HLB 柱纯化后,放射化学纯度超过 95%。体外稳定性极佳,亲水性高(lg P = -4.20 ± 0.09(n = 3))。正常小鼠注射 2 h 后的生物分布研究表明,n-Gluc-Lys([Al18F]NOTA)-TOCA 在肾脏中的摄取量高((13.83 ± 3.52)% ID/g(n = 5)),而在肝脏和骨骼中的摄取量低。萨马他汀胰腺受体表达摄取量高,血液和肌肉本底摄取量低。这些初步结果为进一步研究 Al18F 复合物标记的奥曲肽及其类似物作为肿瘤探针诊断 SSTR 阳性肿瘤提供了一些实验依据。作者
肽修饰
在多肽修饰方面经验丰富,为多肽研究提供了多种可行的途径。
