多肽修饰
N 端修饰
什么是 N 端修饰?
N 端乙酰化可去除多肽氨基末端的电荷。一般来说,如果肽要模拟其在蛋白质中的天然结构,建议进行乙酰化修饰。此外,乙酰化修饰还能稳定肽链,使肽链末端不易被酶降解。
除酰化外,还可进行其他 N 端修饰(如脲、氨基甲酸酯、磺酰胺、烷基胺)。
如果肽的药效学允许,放射性配体通常会连接到肽的 N 端。例如,可以连接 DOTA、NOTA、NODAGA 等。
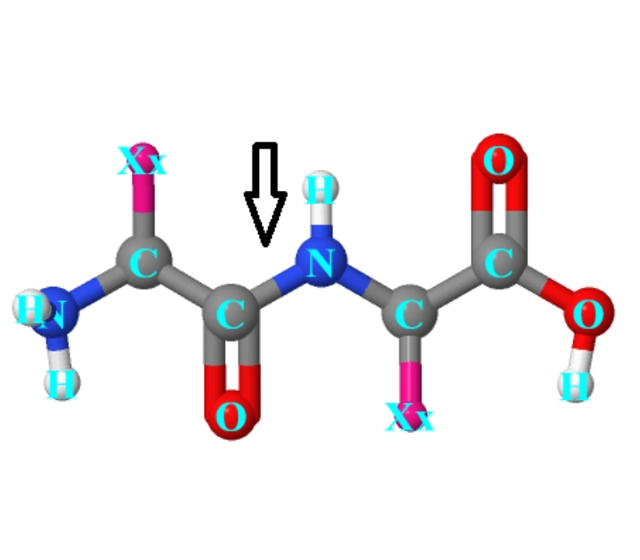
N 端修饰技术
修改类型
N 端修饰能提高多肽的稳定性,因为这种修饰能产生与天然蛋白质结构相似的结构。因此,这种修饰方法可以提高多肽的生物活性,防止酶降解。
|
5-FAM
|
BSA(N 端 -NH2)
|
己酸
|
|---|---|---|
|
5-FAM-Ahx |
CBZ |
水力 |
|
Abz |
丹赛尔 |
KLH(N 端 -NH2) |
|
乙酰化 |
Dansyl-Ahx |
月桂酸 |
|
丙烯酸树脂 |
癸酸 |
硫辛酸 |
|
分配 |
DTPA |
马来酰亚胺 |
|
苯甲酰基 |
脂肪酸 |
MCA |
|
生物素 |
FITC |
肉豆蔻酰 |
|
生物素-Ahx |
FITC-Ahx |
辛酸 |
|
中银 |
Fmoc |
OVA(N 端 -NH2) |
|
Br-Ac- |
甲酰化 |
棕榈酰 |
特色引文
用于 N 端修饰试剂深度特异性分析的蛋白质组衍生肽库
蛋白质和肽的 N 端是利用化学蛋白质组学试剂和生物共轭工具进行选择性修饰的重要目标。N 端 α-amine 在每条多肽链中只出现一次,因此是蛋白质生物共轭的一个有吸引力的靶点。在细胞中,新的 N 端可通过蛋白酶裂解产生,并被 N 端修饰试剂捕获,从而可通过串联质谱(LC-MS/MS)鉴定整个蛋白质组的蛋白酶底物。了解修饰试剂的 N 端序列特异性对上述每种应用都至关重要。蛋白质组衍生肽库结合 LC-MS/MS 是分析 N 端修饰试剂序列特异性的强大工具。这些肽库种类繁多,LC-MS/MS 可在一次实验中分析数以万计序列的修饰效率。蛋白质组衍生肽库是分析酶和化学肽标记试剂序列特异性的有力工具。Subtiligase 和 2-吡啶甲醛(2PCA)是两种用于选择性 N 端肽修饰的试剂,可利用蛋白质组衍生肽库进行研究。本方案概述了生成 N 端多样性蛋白质组衍生肽库以及应用这些肽库分析 N 端修饰试剂特异性的步骤。我们详细介绍了化学修饰试剂 2-吡啶甲醛和酶法修饰试剂 subtiligase 的特异性分析步骤。这些方案很容易适应其他蛋白质组来源和其他 N 端肽标记试剂。
肽修饰
在多肽修饰方面经验丰富,为多肽研究提供了多种可行的途径。
