生物功能和作用机制
Tβ4 是人体内主要的肌动蛋白调节分子之一,具有多种生物学功能,在组织再生、重塑、伤口愈合、维持肌动蛋白平衡、肿瘤发生和转移、细胞凋亡、炎症、血管生成、毛囊发育等生理和病理过程中发挥着重要作用。
资料来源 Tandfonline
- 肌动蛋白调节因子:肌动蛋白约占非肌细胞总蛋白质的 10%,是细胞结构、细胞运动和伤口愈合所需的重要成分。细胞中 Tβ4 的存在足以封存所有肌动蛋白单体,并参与调节肌动蛋白的聚合和解聚。Tβ4 能以 1:1 的比例与肌动蛋白单体结合,阻止 F-肌动蛋白聚合物的形成。Tβ4 与肌动蛋白的结合伴随着结合水的解离。Tβ4 的 C 端与肌动蛋白 His-40 结合,导致肌动蛋白单体发生构象变化。Tβ4 分子包含一个肌动蛋白结合结构域(LKKTET),这是主要的静电接触位点。其 N 端片段可通过立体阻碍抑制肌动蛋白聚合。单独作用时,Tβ4 可抑制肌动蛋白的聚合和核苷酸交换。这与另一种肌动蛋白结合蛋白 Profilin 的作用截然不同,后者能促进 ADP 和 ATP 的交换,加速肌动蛋白的组装。 [1][2]Tβ4 和 Profilin 可协同调节肌动蛋白的组装。Tβ4 可以调节 G-actin 和 F-actin 之间的转换。据报道,在高度流动的血细胞中,Tβ4 的浓度可达 300 pmol,而 Tβ4 与 G-actin 结合所需的浓度不到 20 pmol。随着浓度的增加,Tβ4 会降低 F-actin 的解聚能力。这可能就是 Tβ4 调节细胞微丝系统功能的原因。
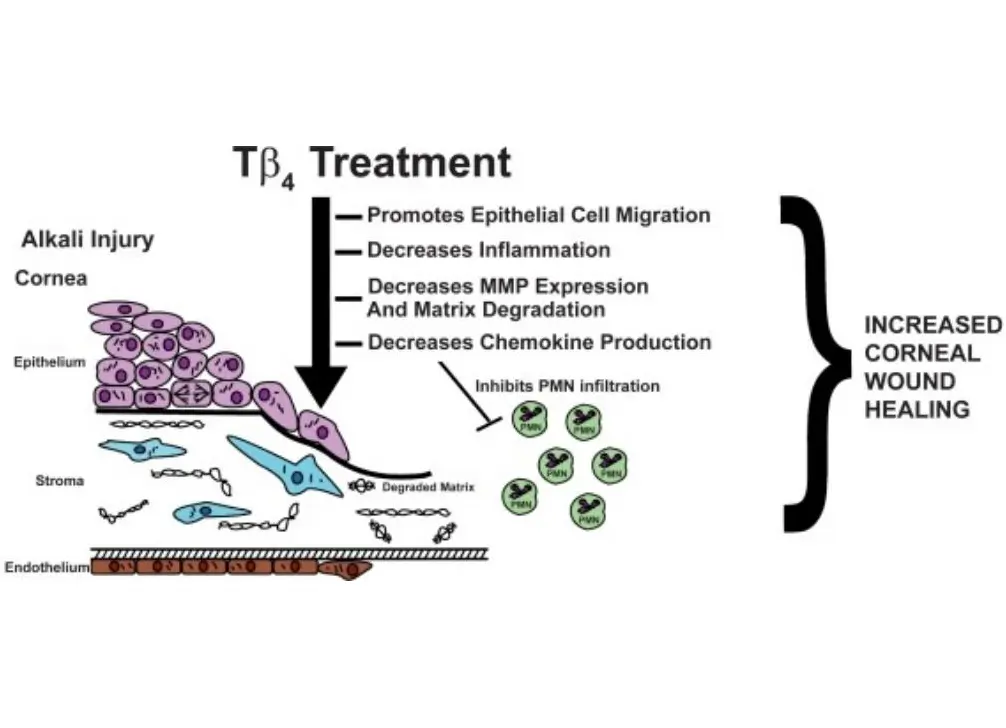
促进内皮细胞迁移和血管生成:利用鸡绒毛膜(CAM)血管生成模型进行的研究表明,当内皮细胞分化成管状结构时,Tβ4 的 mRNA 含量会增加 5 倍,转染 Tβ4 可加速内皮细胞克隆中管状结构的形成。此外,研究还发现,Tβ4 可在转谷氨酰胺酶(因子 XIIIa)的介导下与纤维蛋白和胶原蛋白相互作用,并在血液凝固过程中发挥重要作用。此外,在老化糖尿病小鼠的全厚皮肤损伤实验中,Tβ4 可以加速大面积皮肤伤口和深度烧伤的愈合,促进皮肤和角膜修复,显示出加速伤口愈合的能力。
抑制细胞凋亡:Tβ4 对受到腐蚀性物质(如苯扎氯铵或乙醇)损伤的角膜上皮细胞有明显的保护作用。上调 Tβ4 基因的表达有利于增强细胞的耐缺氧能力。[2][3]
关键炎症分子的下调:伤口愈合是一个复杂的生物过程,可分为三个不同的阶段:炎症、细胞增殖和组织重塑,在每个阶段相关蛋白质的基因表达都会上调,然后下调。对于慢性伤口而言,这一调节过程会受到年龄、潜在疾病和免疫抑制药物等因素的干扰,导致炎症分子产生过多、炎症过度、细胞增殖和组织重塑受阻。研究发现,Tβ4 能降低自由基水平,减缓脂质过氧化,抑制炎症细胞因子如 IL-1、巨噬细胞炎症蛋白 1α (MIP1α)、MIP1β、单核细胞趋化蛋白-1(MCP-1)的产生,降低血栓素和前列腺素 2α 的水平,从而缓解炎症。因此,它可用于治疗炎症性疾病,如节段性肠炎和肌肉萎缩。
刺激成体心外膜干细胞分化:Tβ4 在冠状动脉血管发育的各个方面都起着至关重要的作用,它能显著刺激静止的成年小鼠心外膜移植物的生长,恢复成纤维细胞、平滑肌细胞和内皮细胞的多能性,并诱导其分化。[1][2] 在心脏中敲除 Tβ4 基因会导致 Tβ4 的血管生成裂解产物(AcSDKP)水平显著下降。虽然注射 AcSDKP 不能恢复心脏,但它能显著增强成年小鼠心外膜祖细胞向内皮细胞的分化。这表明,Tβ4和AcSDKP是冠状动脉和新生血管的强刺激因子,Tβ4诱导的成年小鼠心外膜细胞可作为血管再生的来源,导致心脏损伤后受损血管在低水平上持续再生。
刺激毛囊发育:Tβ4 促进毛囊干细胞的迁移、分化和细胞外基质的重建,从而调节毛发生长。对大鼠和小鼠的研究发现,在毛发生长周期中,源自隆起区的特定毛囊角质细胞亚群高度共表达 Tβ4,而毛囊隆起区也存在皮肤干细胞。当 Tβ4 浓度达到纳摩尔水平时,干细胞的迁移和分化就会增强,Tβ4 的存在还会增加细胞外基质降解酶基质金属蛋白酶-2(MMP-2)的表达和分泌。
与肿瘤形成的关系:在甲状腺髓样癌、结肠直肠癌、高度恶性黑色素瘤、乳腺癌和口腔鳞状细胞癌等多种肿瘤细胞中都观察到了 Tβ4 基因的上调。Tβ4 能有效诱导血管内皮生长因子的表达,促进血管生成,激活细胞迁移特性,导致肿瘤恶变。Tβ4 表达上调会导致 E-cadherin 表达下调,削弱细胞粘附性,并增加基质金属蛋白酶的表达,为癌细胞提供生长优势和侵袭特性,从而导致恶性肿瘤。Tβ4 具有抗凋亡能力,Tβ4 表达的增加会降低细胞凋亡的程度,这可能是由于 Tβ4 抑制了细胞色素 c 的释放,破坏了细胞凋亡过程的启动,而细胞凋亡是恶性肿瘤的另一个重要特征。
促进角膜修复:胸腺肽 β4已证明能够促进各种角膜损伤模型的伤口愈合,并调节某些关键细胞因子的产生。研究发现,胸腺肽 β4 可以减少基质金属蛋白酶的表达,促进细胞外基质重塑,激活细胞因子。具体来说,它能抑制基质金属蛋白酶的活性,这与胸腺肽 β4 处理皮肤损伤模型得出的结论相反。 [1][2][3]这表明,在组织修复过程中,特定酶的调节途径既可以上调,也可以下调。
准备方法
目前,用于临床和研究的胸腺肽β4(Tβ4)主要有两种来源:从牛胸腺中提取和化学合成。从牛胸腺中提取 Tβ4 不仅成本高昂,而且受材料供应和提取技术的限制,纯度低、含量低。杂质的存在也带来了许多问题,特别是考虑到牛体内病毒数量的不断增加,这使得提取过程变得更加复杂。随着基因工程的发展,利用基因工程方法生产 Tβ4 将成为一个新的方向。我们实验室计划将人工合成的 Tβ4 在植物中进行串联表达,以获得高效表达 Tβ4 的转基因植物。与天然提取的 Tβ4 相比,利用转基因植物生产的 Tβ4 具有生物活性更高、纯度更高、副作用更小等优点。此外,它还是降低生产成本、减少污染和实现大规模生产的最佳方法。[3]
背景介绍
胸腺肽 beta 4 是一种由 43 个氨基酸残基组成的多肽,等电点为 5.1,在哺乳动物中高度保守。与胸腺肽α或类似的胸腺肽不同,它是一种细胞质蛋白,而不是核蛋白。 [2][3]胸腺肽 beta 4 参与多种生理功能,包括免疫功能、神经系统发育、伤口愈合和肌动蛋白功能。
与胸腺肽α或类似的胸腺肽不同,胸腺肽β4是一种细胞质蛋白,而不是核蛋白。它含有较少的疏水性氨基酸,不含 Lys-Lys-Xaa-Lys 结构区域。化学构象研究表明,胸腺肽 beta 4 以单链形式存在并发挥功能。它在残基 31-43 和 18-30 之间有一个内部重复区,其中有六个相同的氨基酸。虽然在残基 4-12 和 32-40 之间有两个高度螺旋的区域,但胸腺肽 beta 4 并没有形成脯氨酸转折。在生物分布和表达方面,胸腺肽 beta 4 最初是从胸腺中纯化出来的。因此,人们最初认为它是一种作用于早期 T 细胞成熟的胸腺激素。然而,胸腺肽 beta 4 广泛存在于其他组织、器官和细胞中,在脾脏、胸腺、肺和腹腔巨噬细胞中的含量最高,其次是大脑、肝脏、肾脏、睾丸和心脏。即使是非网状内皮系统细胞,如成纤维细胞,也能合成胸腺肽 beta 4。胸腺细胞的胸腺肽 β4mRNA水平比胸腺基质细胞高七倍,而且在各种血液细胞中都能观察到胸腺肽 β4的表达。对胸腺肽 beta 4 cDNA 的研究表明,它缺乏信号肽。[1] 虽然人体内也有缺乏信号肽的分泌蛋白,如白细胞介素-1(IL-1)和内皮生长因子,但专家们仍然认为胸腺肽 beta 4 不太可能是一种分泌蛋白,而更有可能是某些基本细胞功能所必需的。
应用
利用胸腺肽β4 (Tβ4) 优化内皮祖细胞功能的基础与应用研究
缺血性心血管疾病的发病率和死亡率逐年上升,严重威胁人类健康。这些疾病的发病机制非常复杂,而内皮细胞功能障碍在缺血性心血管疾病的发生发展中起着至关重要的作用。虽然成熟的内皮细胞可以修复内皮损伤,但其再生能力有限。内皮祖细胞(EPCs)是血管内皮细胞的一种前体细胞,具有分化为内皮细胞的潜能。大量研究表明,EPCs 在血管修复和新生血管形成中发挥着各种作用。然而,EPC 移植的临床应用仍面临许多挑战。一些心血管疾病或危险因素,如衰老、高血压、高胆固醇血症和糖尿病等,会减少循环中EPC的数量并损害其功能,从而大大限制了其在缺血性心血管疾病中的应用。因此,改善EPCs的功能将是未来EPC移植治疗的重要策略。[1][2]
胸腺肽β4(Tβ4)是一种由43个氨基酸残基组成的低分子量蛋白质,参与介导血管生成、伤口愈合和炎症控制等多种生物反应。我们之前的研究发现,Tβ4 可促进人外周血 EPCs 的增殖和迁移,同时抑制其凋亡和衰老。Tβ4 能明显增强 EPCs 的血管生成能力,与剂量呈依赖关系,1000 ng/mL 时效果最大(与对照组相比,33.33±1.86 vs 18.34±2.02,P<0.05)。Western 印迹分析表明,Tβ4 促进 Akt Ser473 和 eNOS Ser1177 的磷酸化,也表现出剂量依赖关系。Akt siRNA 和 eNOS siRNA 都能明显抑制 Tβ4 对 EPCs 的促血管生成作用。
- 治疗皮肤伤口
- 治疗心脑血管损伤
- 眼外伤治疗
- 其他应用
由于其生物功能,包括促进内皮细胞迁移、防止细胞凋亡、抗炎作用和促进毛囊发育,Tβ4 在护肤、抗皮肤老化和促进头发再生等医疗保健方面也显示出巨大的潜力。