多肽修饰
多肽生物素化
什么是多肽生物素化?
检测适当标记的肽或生物素化肽(如使用标记抗体) 生物素化肽或标记肽与非标记肽的分离(如使用系留抗体)
标签可以是小的有机分子,如生物素(与链霉亲和素有很强的非共价结合力),也可以是短肽序列。用作标签的肽序列最常见的例子是表位标签,如 Flag 标签、HA 标签和 Myc 标签。最近开发的一种标签是 ALFA 多肽标签。对于所有标签,市场上都有抗体出售。相关序列见下文。
MOL Changes 公司经常合成带有各种标签的标记肽。标签通常连接在 N 端或 C 端(通过赖氨酸或半胱氨酸),但原则上也可以放置在任何位置。所有标签都可以通过各种不同长度和极性的所谓连接体或间隔分子与肽分开。如果需要,可以通过还原敏感的二硫键等方法使连接体可被裂解。请查看链接物/间隔物/聚乙二醇化物列表。以下是经常加入的标签。
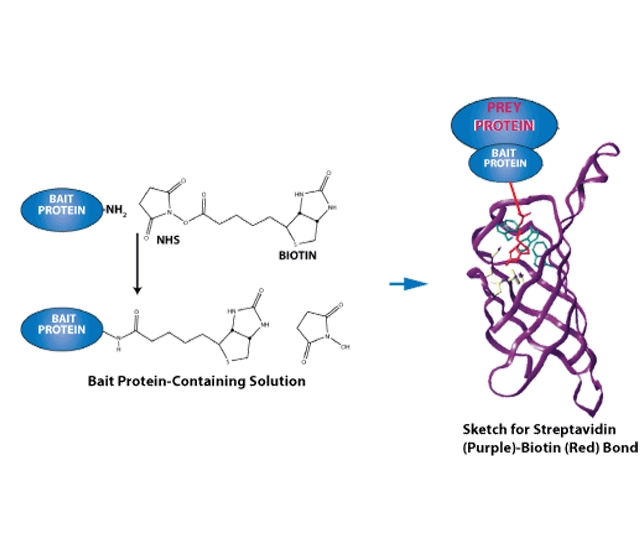
生物素化和标记肽
生物素等亲和标记可用于
-检测适当标记的肽或生物素化肽(如使用标记抗体)
-生物素化肽或标记肽与非标记肽的分离(如使用系留抗体)
标签可以是小的有机分子,如生物素(与链霉亲和素有很强的非共价结合力),也可以是短肽序列。用作标签的肽序列最常见的例子是表位标签,如 Flag 标签、HA 标签和 Myc 标签。最近开发的一种标签是 ALFA 多肽标签。对于所有标签,市场上都有抗体出售。相关序列见下文。
MOL Changes 公司经常合成带有各种标签的标记肽。标签通常连接在 N 端或 C 端(通过赖氨酸或半胱氨酸),但原则上也可以放置在任何位置。所有标签都可以通过各种不同长度和极性的所谓连接体或间隔分子与肽分开。如果需要,可以通过还原敏感的二硫键等方法使连接体可被裂解。
|
亲和力标签
|
序列
|
评论
|
|---|---|---|
|
旗帜标签 |
DYKDDDDK |
抗旗帜抗体 |
|
HA 标签 |
YPYDVPDYA |
抗 HA 抗体 |
|
Myc 标记 |
EQKLISEEDL |
抗 Myc 抗体 |
|
人民党
|
序列
|
评论
|
|---|---|---|
|
塔特 (47-57) |
YGRKKRRQRRR |
细胞穿透肽 |
|
低聚精氨酸 |
RRRRRRRRR |
细胞穿透肽 |
MOL Changes 还能为您提供附在肽上的各种反应性标签。例如引入
- 叠氮化物(与碱反应--点击化学)
- 马来酰亚胺(与硫醇(如 Cys)反应
- 硫醇(与马来酰亚胺反应)
- Cys(Pys/Npys)(与硫醇反应生成二硫化物)
特色引文
髓系特异性人 CD33 是一种抑制性受体,在招募磷酸酶 SHP-1 和 SHP-2 方面具有不同的 ITIM 功能
CD33 是一种髓系特异性硅酸结合受体家族成员,在髓系祖细胞中表达量很高,但在分化细胞中的表达量要低得多。人类 CD33 的细胞质结构域中有两个酪氨酸残基(Y340 和 Y358)。当磷酸化时,这些酪氨酸可作为磷酸酶 SHP-1 和/或 SHP-2 的对接位点,使 CD33 发挥抑制受体的作用。在这里,我们证明了 CD33 在磷酸酶抑制剂 pervanadate 的存在下会发生酪氨酸磷酸化,并招募 SHP-1 和 SHP-2。共表达研究表明,Src 家族激酶 Lck 能有效地使 Y340 磷酸化,但不能使 Y358 磷酸化,这表明这些残基可能在选择性招募适配器分子时起作用,并具有不同的功能。肽结合研究进一步支持了 Y340 和 Y358 的重叠但非冗余的作用,该研究显示 SHP-1 和 SHP-2 都被招募到 Y340 上,但只有 SHP-2 被招募到 Y358 上。利用 SHP-1 的突变体进行的分析表明,CD33 的 Y340 主要与 SHP-1 的氨基 Src 同源-2 结构域结合。CD33 能够下调 CD64 在 U937 中诱导的钙动员,这证明了 CD33 作为抑制性受体的潜在功能。通过用显性阴性 SHP-1 阻断 CD33 介导的效应,证明了这种抑制作用依赖于 SHP-1。这一结果意味着 CD33 是一种抑制性受体,而且 SHP-1 磷酸化酶在介导 CD33 功能方面起着重要作用。进一步的研究对于确定 CD33 在体内抑制的受体及其在髓系发育中的功能至关重要。
肽修饰
在多肽修饰方面经验丰富,为多肽研究提供了多种可行的途径。
