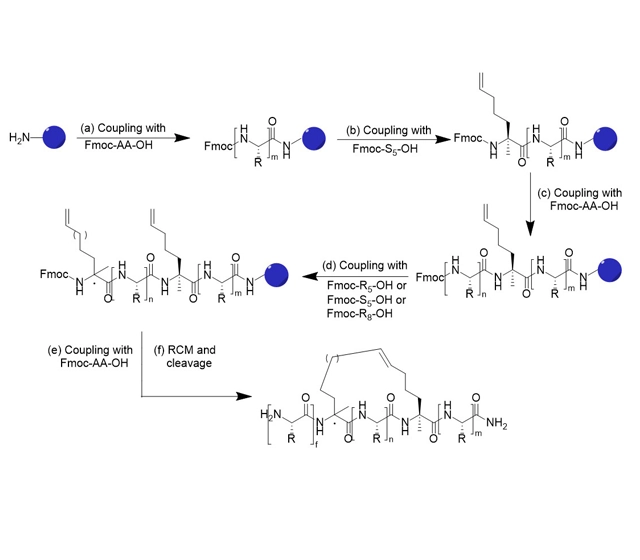
多肽修饰
钉肽
什么是标签肽?
研究表明,具有α螺旋结构且富含正电荷的多肽可以穿过细胞膜。然而,一旦脱离母体,多肽就无法保持原有的二级结构,构象的不稳定性导致其与蛋白质的结合力减弱,而普通的线性多肽则无法穿过细胞膜,很容易被水解。经过不断尝试,Verdine 等人开发出了一种新结构的多肽,这种多肽被称为钉肽,它是一种具有α-螺旋结构的全碳支架,全碳支架稳定了α-螺旋结构,加强了多肽分子与蛋白质之间的相互作用,钉肽可以穿过细胞膜,不易被水解,与以往的小分子药物和蛋白质类药物相比,具有更高的药理活性。与以往的小分子药物和蛋白质药物相比,具有更高的药理活性。
钉肽科学
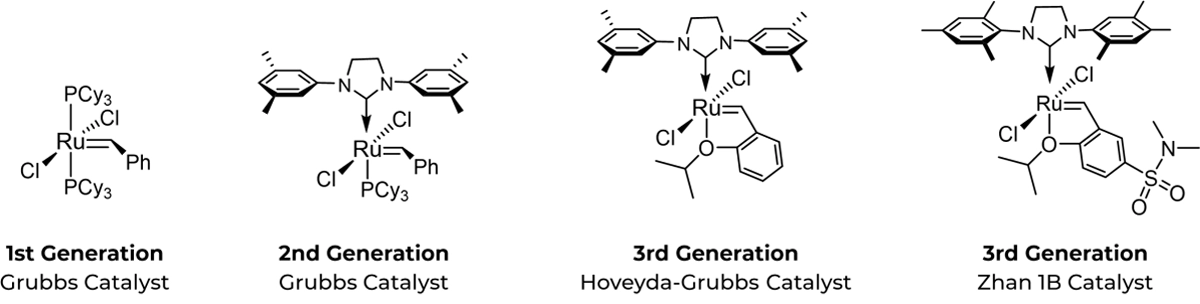
短肽合成与普通肽合成的区别在于,在肽链的固相合成过程中引入两个含有α-甲基和α-烯基的非天然氨基酸,然后两个非天然氨基酸之间发生烯烃络合分解反应,形成具有稳定α-螺旋构象的全碳支架,进而合成短肽。
钉肽化学
带有三环己基膦(PCy3)配体和顶端定位碳烯碳的第一代格拉布斯催化剂(左)是一种相对稳定的钌络合物,用于肽的烯烃偏聚反应。随后的研究设计出了热稳定性更高的格拉布斯第二代催化剂(中)。第三代催化剂也称为 Hoveyda-Grubbs 催化剂(右图),它将 N-杂环碳配体替换为苯亚甲基配体,苯亚甲基配体的苯环上连接有一个螯合原异丙氧基。
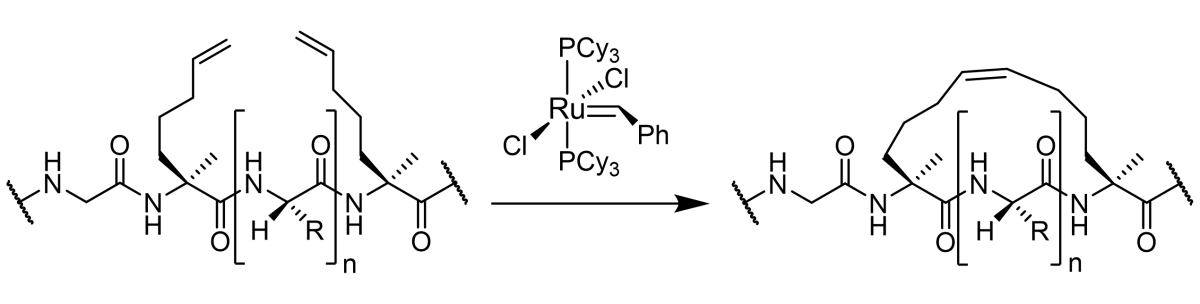
单钉肽反应
单钉肽反应。在肽链中加入两个α-4-正戊基丙氨酸(S5)残基,就能进行闭环偏析(即格拉布斯反应),生成单钉书针肽。当 n = 3 时(即在 S5 残基之间有 3 个氨基酸),主链类型被称为 i,i + 4。
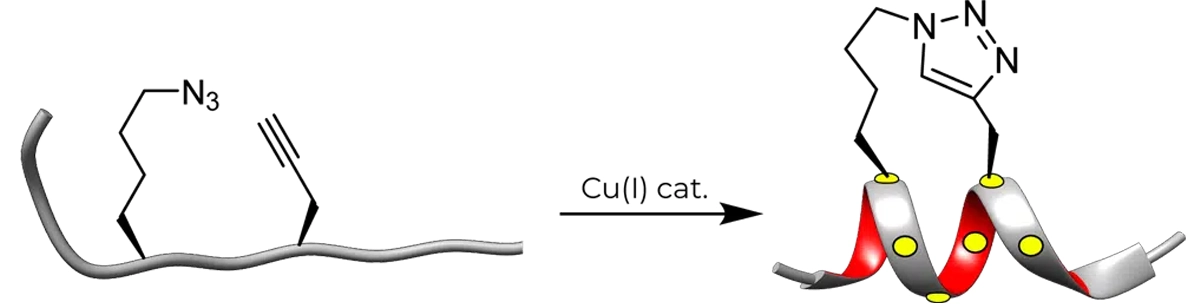
单钉配置
点击 "反应(铜催化的 Huisgen 1,3-二极环加成反应)效率高、条件温和,而且易于合成所需的非天然氨基酸,因此可以方便地合成三唑叠肽。例如,L- Nle(εN3)和 D-Pra(D-丙炔基丙氨酸)在 i 和 i+4 位的取代组合可用于生成单一的三唑叠肽。
特色引文
具有体内活性的钉肽设计规则及其在 Mdm2/X 拮抗剂中的应用。
Although stapled α-helical peptides can address challenging targets, their advancement is impeded by poor understandings for making them cell permeable while avoiding off-target toxicities. By synthesizing >350 molecules, we present workflows for identifying stapled peptides against Mdm2(X) with in vivo activity and no off-target effects. Key insights include a clear correlation between lipophilicity and permeability, removal of positive charge to avoid off-target toxicities, judicious anionic residue placement to enhance solubility/behavior, optimization of C-terminal length/helicity to enhance potency, and optimization of staple type/number to avoid polypharmacology. Workflow application gives peptides with >292x improved cell proliferation potencies and no off-target cell proliferation effects ( > 3800x on-target index). Application of these ‘design rules’ to a distinct Mdm2(X) peptide series improves ( > 150x) cellular potencies and removes off-target toxicities. The outlined workflow should facilitate therapeutic impacts, especially for those targets such as Mdm2(X) that have hydrophobic interfaces and are targetable with a helical motif.
肽修饰
在多肽修饰方面经验丰富,为多肽研究提供了多种可行的途径。
