製品情報ナビゲーション
KPVの構造
- シーケンス:リス・プロ・ヴァル
- CAS番号67727-97-3
- 分子式:C16H30N4O4
- 分子量: 342.43 g/mol
KPVとは?
KPVはα-メラノサイト刺激ホルモン(α-MSH)のC末端ペプチドフラグメントである。KPVはα-MSHの短いペプチド誘導体の一つであり、光保護作用、抗虚血作用、性的作用、摂食行動やエネルギー恒常性維持に同様の効果があるかどうかを調べるために試験されている。
KPVはリジン-プロリン-バリンからなり、顕著な抗炎症作用があり、このペプチドは炎症性腸疾患の治療薬として活発に研究されている。中枢神経系、消化管、肺、血管系、関節における強力な抗炎症活性の証拠があり、KPVは小さなペプチドであるため、経口、静脈内、経皮などさまざまな方法で投与することができる。
KPVの効果
腸の炎症
おそらくKPV研究で最も重要な発見は、このペプチドが腸の炎症を抑えることであろう。炎症性腸疾患(IBD)モデルマウスにおいて、KPVは炎症性浸潤、MPO活性、全体的な組織学的エビデンスを減少させるという確かな結果を示し、KPVを投与したマウスはプラセボを投与したマウスよりも回復が早く、体重も増加した。
KPVデリバリーのメカニズムに関する更なる研究から、KPVをヒアルロン酸で機能化したナノ粒子に担持させることで、ペプチドの炎症作用を腸内の適切な部位に向けることができることが示された。マウスモデルでは、これによって粘膜治癒が促進され、TNF-αを強くダウンレギュレートすることによって炎症が軽減された。多くの点で、KPVは、体内の他の場所にあるTNF-αに影響を与えることなくIBDの炎症を抑える、より効果的で的を絞ったアプローチである。これはペプチドの有効性を高めるものではないが、効力や効果を得るために必要な総用量には影響する。
KPVは炎症が過剰な場合にのみ効果があるようだ。正常組織にはほとんど効果がない。これは、少なくとも部分的には、KPVが炎症状態では制御されない輸送タンパク質を介して結腸細胞に入るためである。このことは、KPVがIBDの予防薬あるいは維持薬として有効であることを示唆している。休息期間中であっても効果がないわけではないので、服用しても安全である。KPVの胃腸に対する潜在的な効果について多くの研究を主導してきたディディエ・メルラン教授は、最近、このペプチドがPepT1というタンパク質チャネルを介して大腸細胞に入ることを発見した。このことは、KPVがすでに炎症を起こしている環境でより効果的である理由を説明するのに役立つ。このことはまた、様々な病態に応用可能な薬物送達の新しい方法を示唆している。たとえそれが直接病気の原因でなくても、病気の状態で変化するタンパク質をターゲットにすることで、薬剤の活性を特定の部位に集中させることができる。これにより、重篤な副作用を伴う薬剤の投与量を減らしたり、それ自体には効果がないものの、適切な病態において強力な治療効果を発揮する薬剤を開発したりすることができる。
一般的な抗炎症剤としてのKPV
早くも1984年には、ウサギを使った研究で、KPVが強力な抗炎症作用と解熱作用を持つことが示されている。しかし、この場合、KPVは無傷のα-MSH分子よりも効力が弱かった。このことから、当時の科学者たちは、KPVには完全な解熱活性に必要なα-MSH分子のある部分が欠けていることがわかった[5]。その後数十年にわたり、α-MSHの様々な修飾体について研究が続けられた。
おそらくこれらの試験から得られた最大の教訓は、α-MSHとその類似体の両方が、幅広い疾患において炎症を抑えるということであろう。現在までに、これらの分子は発熱、刺激性・アレルギー性接触皮膚炎、血管炎、線維症、関節炎、目、脳、肺、消化管の炎症でテストされている。すべての場合において、α-MSHは最も効果的な抗炎症剤である。残念なことに、α-MSHには一つ大きな副作用がある。一方、KPVにはこの副作用はない。KPVは無傷のα-MSHほど効果的ではないが、副作用がないということは、ほとんどの場合、望ましい目標効果を達成するためにレベルを上げることが理論的に可能だということである。
α-MSHの抗炎症作用のほとんどはKPV分画によるものであるため、効力の差はせいぜいわずかであることが分かっている。しかし、興味深いことに、α-MSHの親分子は後期の炎症反応をより抑制することができるようである。例えば、接触性皮膚炎では、α-MSHは最初の暴露から2週間後までのアレルギー性炎症反応をよりよく抑制する。このことは、α-MSHが、即時的な炎症反応とは関係のない、免疫調節の何らかの側面に影響を及ぼしている可能性を示唆している [7]。このプロセスが何であるかは、まだ解明されていない。
この図は、24時間後(左)と2週間後(右)の接触皮膚炎による耳の腫れを示している。24時間後では、KPVと刺激物の共投与は、α-MSHと刺激物の共投与とほぼ同じ効果がある。しかし2週間後では、ペプチドを共投与せずに刺激物に暴露した場合、α-MSHの膨潤はKPVに比べてはるかに少なかった。
創傷治癒
創傷治癒は複雑な生理学的プロセスである。科学者たちは創傷治癒プロセスの一般的な3つの段階、すなわち炎症、増殖、リモデリングを同定している。各段階は細胞集団とサイトカイン濃度の違いによって特徴づけられ、介入の可能性がある独自の化学的/生理学的環境を示している。創傷治癒過程の各段階は、それぞれ異なる皮膚細胞のサブタイプによって特徴づけられるが、大部分の細胞はα-メラノサイト刺激ホルモンと結合するメラノコルチン1受容体(MC1R)を発現していることが、研究によって示されている。もちろんこれは、これらの細胞タイプがKPVやKdPTのようなα-MSHアナログとも結合することを意味する。
これらのα-MSH誘導体はα-MSHの性質の一部を保持するが、他の性質を欠くので、創傷治癒に有益である可能性がある。例えば、KPVはα-MSHの炎症特性を提供するが、親ペプチドの色素誘導活性を欠いている。このため、KPVは創傷治癒を改善し、自然な瘢痕形成に通常伴う特徴的な皮膚の変化(皮膚の黒い人に不釣り合いに影響する現象)を回避するのに適した候補となる。
KPVの抗炎症作用の理由の一つは、2つの一般的な皮膚病原体に対する自然免疫反応への関与である。研究では、KPVが黄色ブドウ球菌とカンジダ・アルビカンスの増殖を抑制することが示されている。KPVのこのような利点は、他の抗炎症薬とは対照的で、感染と闘う身体の能力を実際に阻害してしまう。したがって、KPVは抗炎症活性と抗菌活性を兼ね備えている。
KPVは、ペプチドの抗真菌作用を新規治療薬で再現することを目的とした最近の研究において、実際に構造モデルとなっている。つまり、KPVの3次元構造が強力な抗真菌剤となっており、この構造を再現することで、研究者は同じ抗真菌活性を持ちながら、他の生物学的プロセスに対して異なる作用を持つ化合物を開発できる可能性があるというのだ。
傷跡の形成
創傷治癒の第一段階(炎症)におけるKPVの既知の効果に基づき、本研究では創傷治癒の他の2つの段階における役割も調査した。KPVは肥厚性瘢痕(瘢痕など)の形成につながる慢性炎症を軽減するようである。このタイプの瘢痕形成は、広範なマクロファージ浸潤、TNF免疫反応性、好中球の多さが特徴である。このような状況でα-MSHを使用すると、瘢痕が小さくなり、劇的な炎症反応も少なくなる。同様の効果は肺や心臓など他の組織でも認められている。これらの知見は、特定の化学療法剤で見られる瘢痕化を防ぐためにKPVを使用することができるという希望を与えるもので、がん治療の副作用を軽減するだけでなく、これらの薬剤の濃度を高め、それによってがん治療の有効性を向上させる。
参考文献
- M.E.ヒルツとJ.M.リプトン、"神経ペプチドα-MSHのCOOH末端フラグメントの抗炎症活性"。 FASEB J. Off.Publ.Fed.Am.Soc. Exp.3巻、11号、2282-2284頁、1989年9月。
- K.カンネンギッサー 他メラノコルチン由来のトリペプチドKPVは、炎症性腸疾患のマウスモデルにおいて抗炎症性を示す。 Inflamm.Bowel Dis.第14巻、第3号、2008年3月、324-331頁。3, pp. 324-331, Mar. 2008, doi: 10.1002/ibd.20334.
- B.シャオ 他ヒアルロン酸機能化ナノ粒子を介したトリペプチドKPVの経口投与は潰瘍性大腸炎を効果的に緩和する", "Orally Targeted Delivery of Tripeptide KPV via Hyaluronic Acid-Functionalized Nanoparticles Efficiently Alleviates Ulcerative Colitis". Mol.Ther.J. Am.Soc. Gene Ther.25, no. 7, pp. 1628-1640, 05 2017, doi: 10.1016/j.ymthe.2016.11.020.
- G. Dalmasso, L. Charrier-Hisamuddin, H. T. T. Nguyen, Y. Yan, S. Sitaraman, and D. Merlin, "PepT1-Mediated Tripeptide KPV Uptake Reduces Intestinal Inflammation,". 消化器内科134巻、1号、166-178頁、2008年1月、doi: 10.1053/j.gastro.2007.10.026。
- D.B. Richards and J. M. Lipton, "Effect of alpha-MSH 11-13 (lysine-proline-valine) on the fever in the rabbit," ウサギの発熱に対するα-MSH11-13(リジン・プロリン・バリン)の効果。 ペプチド第5巻、第4号、815-817頁、1984年8月、do.4, pp. 815-817, Aug. 1984, doi: 10.1016/0196-9781(84)90027-5.
- T.Brzoska、T. A. Luger、C. Maaser、C. Abels、およびM. Böhm、"α-メラノサイト刺激ホルモンおよび関連トリペプチド:生化学、in vitroおよびin vivoにおける抗炎症作用および保護作用、ならびに免疫介在性炎症性疾患の治療に対する将来の展望"、"α-メラノサイト刺激ホルモンおよび関連トリペプチド:生化学、in vitroおよびin vivoにおける抗炎症作用および保護作用、ならびに免疫介在性炎症性疾患の治療に対する将来の展望"。 Endocr.Rev.vol. 29, no.5, pp. 581-602, Aug. 2008, doi: 10.1210/er.2007-0027.
- T.A. Luger and T. Brzoska, "α-MSH関連ペプチド:抗炎症薬および免疫調節薬の新しいクラス",". Ann.Rheum.Dis.66, no.Suppl 3, pp. iii52-iii55, Nov. 2007, doi: 10.1136/ard.2007.079780.
- M.Cutuli, S. Cristiani, J. M. Lipton, and A. Catania, "Antimicrobial effects of alpha-MSH peptides,". J.Leukoc.Biol.67巻2号、233-239頁、2000年2月、doi: 10.1002/jlb.67.2.233。
- M.F・マスマン 他His-Phe-Arg-Trp-NH2および抗真菌特性を有する類似体の合成と構造解析"," Bioorg.Med.Chem.14巻、22号、7604-7614頁、2006年11月、doi: 10.1016/j.bmc.2006.07.007。
- K.S・デ・スーザ 他α-メラノサイト刺激ホルモンの腹腔内注射による皮膚創傷治癒の改善」。 Exp.Dermatol.vol. 24, no.3, pp. 198-203, Mar. 2015, doi: 10.1111/exd.12609.
- C.ロナティ 他ラット肝部分切除後の再生肝におけるNDP-MSHの調節効果"," ペプチド50巻、145-152頁、2013年12月、doi: 10.1016/j.peptides.2013.10.014。
- G・コロンボ 他"遺伝子発現プロファイリングにより、実験的心臓移植におけるペプチドα-メラノサイト刺激ホルモンの複数の保護的影響が明らかになった。" J.Immunol.Baltim.1950年175, no.5, pp. 3391-3401, Sep. 2005, doi: 10.4049/jimmunol.175.5.3391.
- G・コロンボ 他急性肺損傷におけるα-メラノサイト刺激ホルモンの産生とその影響」。 ショック オーガスタ・ガ第27巻、第3号、326-333頁、2007年3月。3, pp. 326-333, Mar. 2007, doi: 10.1097/01.shk.0000239764.80033.7e.
- M.シラー 他ヒト皮膚線維芽細胞はプロホルモン転換酵素1および2を発現し、プロオピオメラノコルチン由来ペプチドを産生する。 J.Invest.Dermatol.117巻、2号、227-235頁、2001年8月、doi: 10.1046/j.0022-202x.2001.01412.x。
- T.Brzoska, M. Böhm, A. Lügering, K. Loser, and T. A. Luger, "Terminal signal: anti-inflammatory effects of α-melanocyte-stimulating hormone related peptides beyond the pharmacophore,". Adv. Exp.Med.Biol.681, 107-116, 2010, doi: 10.1007/978-1-4419-6354-3_8.
- S.J. Getting, H. B. Schiöth, and M. Perretti, "Dissection of anti-inflammatory effect of the core and C-terminal (KPV) alpha-melanocyte-stimulating hormone peptides,". J.Pharmacol.Exp. Ther.306巻2号、631-637頁、2003年8月、doi: 10.1124/jpet.103.051623。
- K.Pawar, C. S. Kolli, V. K. Rangari, and R. J. Babu, "Transdermal Iontophoretic Delivery of Lysine-Proline-Valine (KPV) Peptide Across Microporated Human Skin,". J.Pharm.Sci.106, no. 7, pp. 1814-1820, Jul. 2017, doi: 10.1016/j.xphs.2017.03.017.
本ウェブサイトで提供されるすべての記事および製品情報は、情報提供および教育目的のみのものです。
この医師/科学者は、理由の如何を問わず、本製品の購入、販売、使用を支持または推奨するものではありません。商船三井チェンジズは、この医師とは、黙示的か否かを問わず、いかなる提携関係も関係もありません。この医師を引用する目的は、このペプチドを研究している科学者による徹底的な研究開発の成果を認め、賞賛することにあります。
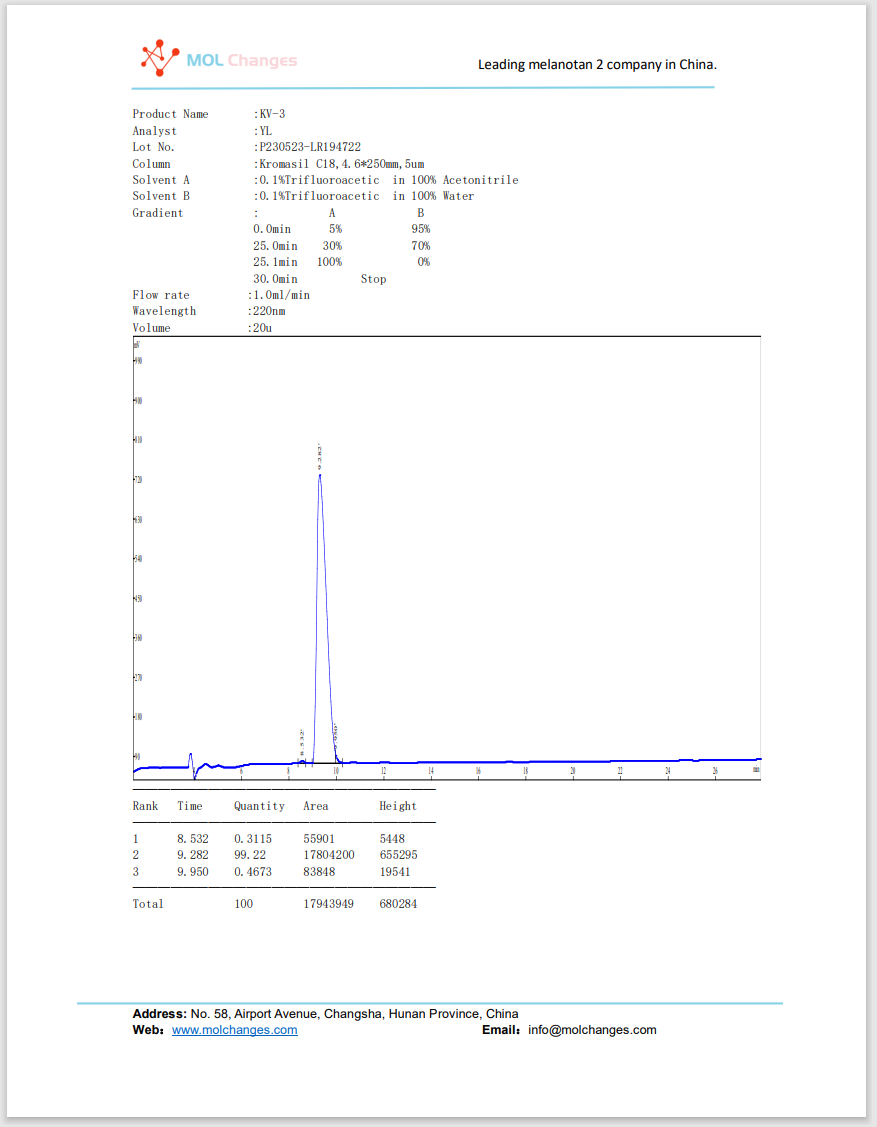
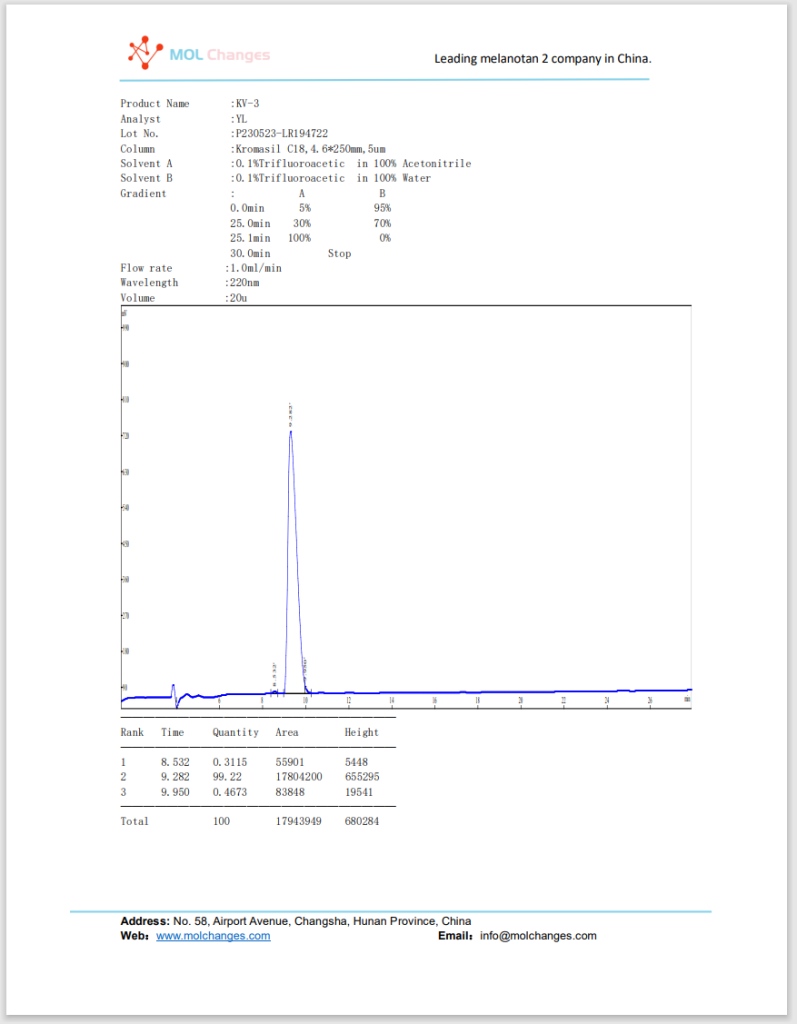
HPLC試験報告書
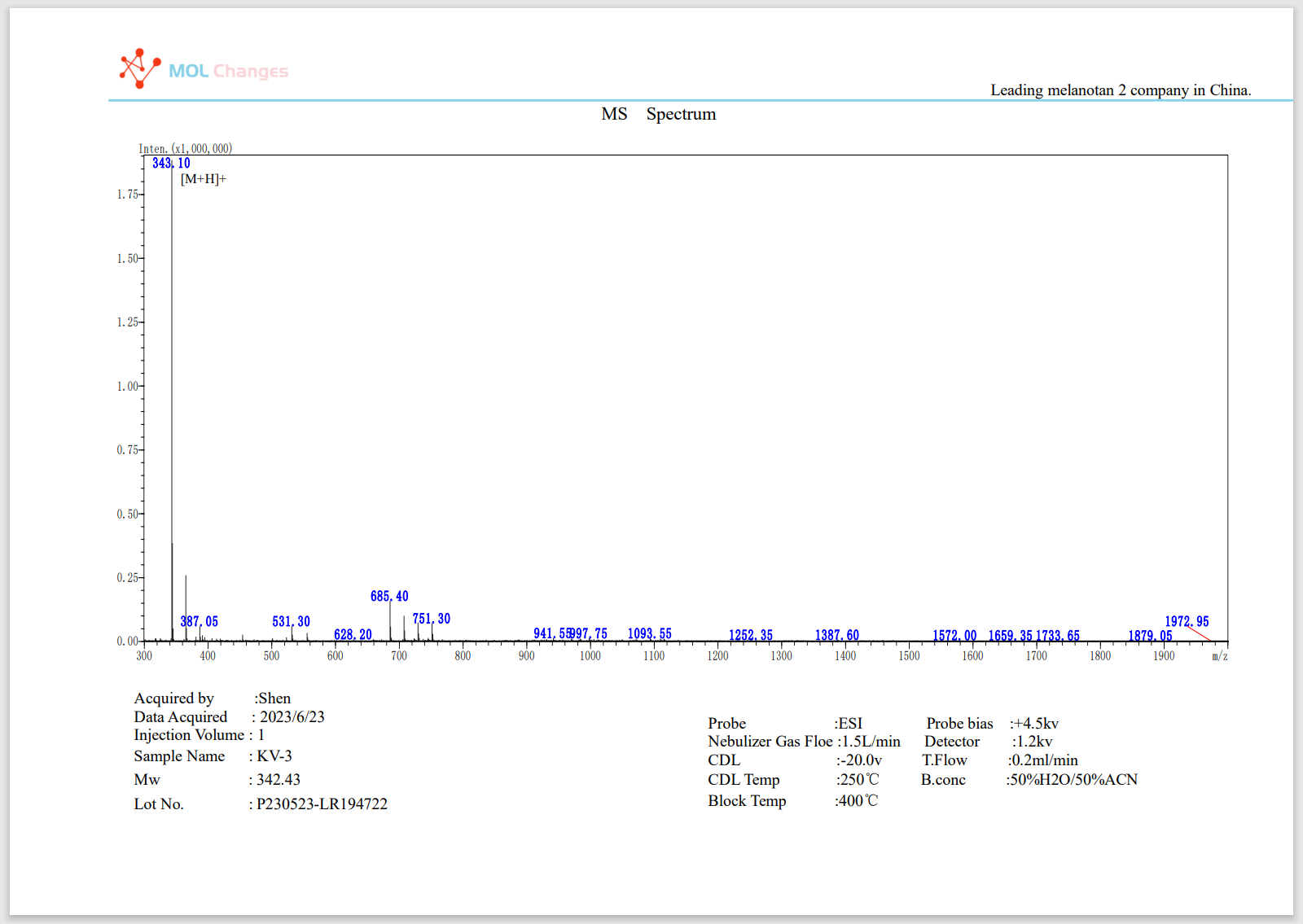
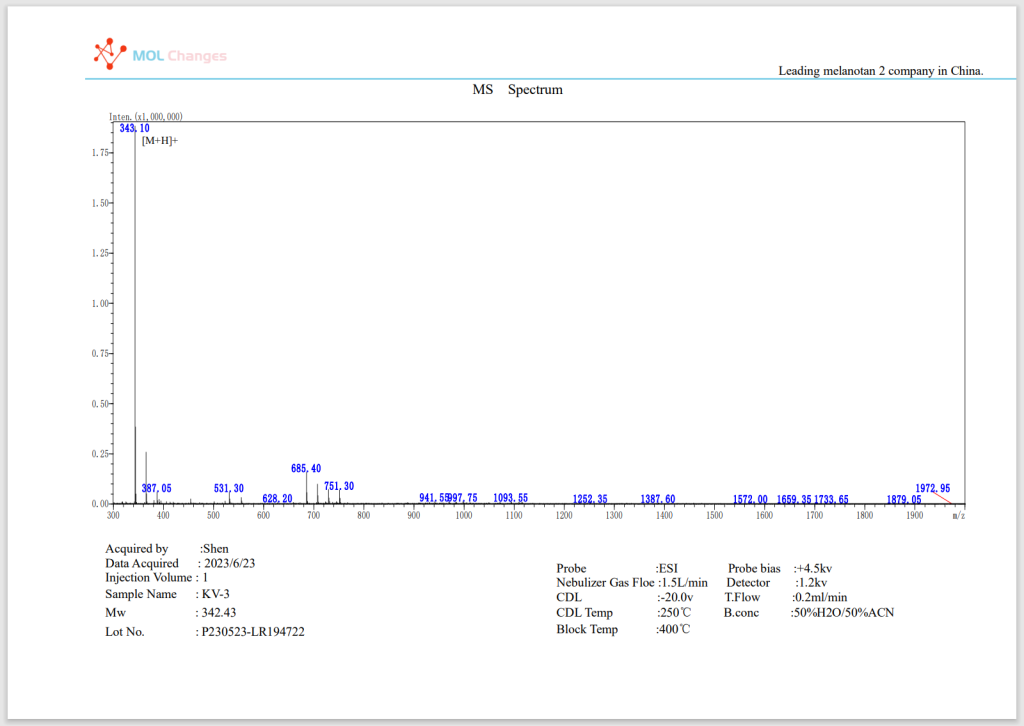
MSテストレポート
メーカー情報
- KPVは商船三井チェンジス工場で製造されている。
- KPV サプライヤー商船三井の変更。
- 最大許容生産量:100000本。
- 含有量基準:ネットペプチド。
- 純度:全製品で98%以上。
- カスタマイズ1mg-1g サイズのカスタマイズは受諾可能である