製品情報ナビゲーション
PE-22-28 構造
- シーケンス:GVSWGLR
- CAS番号:/
- 分子式:C35H55N11O9
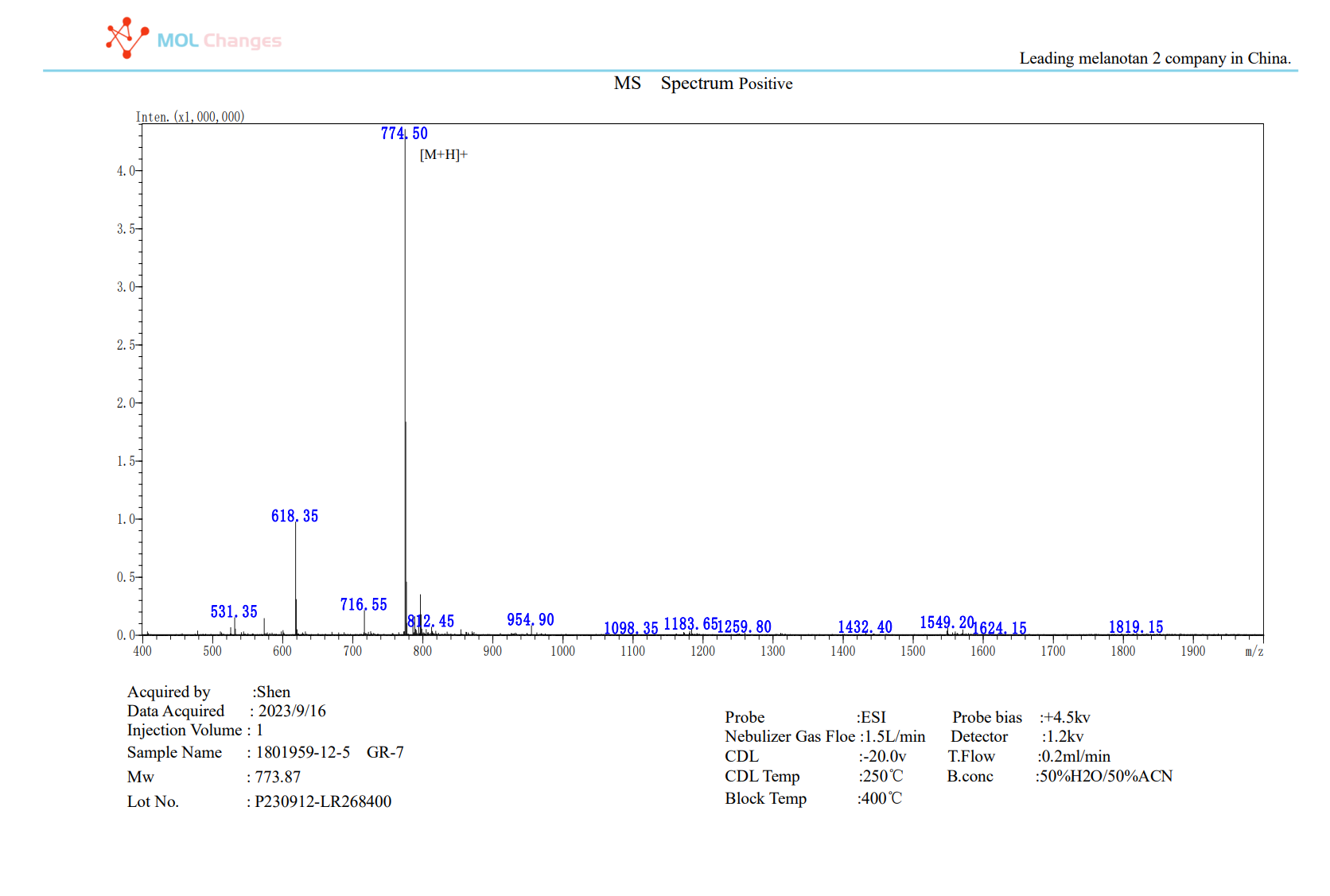
- 分子量: 773.8947 g/mol
PE-22-28とは?
PE-22-28は、天然に存在するペプチドspadinの合成誘導体であり、sortinに由来する分泌ペプチドである。このペプチドはTREK-1(TWIK-associated potassium channel)の受容体に対する拮抗薬であり、TREK-1は二重膜カリウムチャネルであり、うつ病の治療標的および神経原性モジュレーターの可能性が指摘されている。マウスを用いた初期の研究では、TREK-1受容体を欠失させるとうつ病に抵抗できることが示された。同様に、スパジンを投与すると、うつ病に対する抵抗性が増強され、神経細胞の成長と神経細胞間のシナプス相互結合が促進される。
興味深いことに、スパジンの短縮アナログは、スパジンそのものよりも実際に優れたTREK-1阻害作用を示す。PE-22-28は、このスパジンアナログの組み合わせの代表的なペプチドである。PE-22-28は、天然に存在するスパジンよりも安定であり、抗うつ活性と神経原性特性が改善されていることが示されている。
抗うつ薬(SSRIなど)の服用による長期的な結果のひとつに、神経新生があることは注目に値する。実際、新しいニューロンの成長は、うつ病が適切に治療され、抗うつ薬が効いていることのしるしと考えられている。PE-22-28はわずか4日後に神経新生を誘導することが示されており、これは既知のどの抗うつ薬よりもはるかに速い。このことはまた、PE-22-28が学習、脳卒中の回復、そしておそらく神経変性疾患との戦いのような他の用途にも有用であることを示唆している。
TREK-1は主に脳に存在するが、心臓、平滑筋細胞、肺組織、前立腺、膵臓の特定の領域にも存在する。TREK-1は主に抗うつ活性標的として研究されてきたが、痛みの知覚、麻酔、神経保護において重要な役割を果たしている。このような特性から、TREK-1は学界と産業界の両方における研究の格好のターゲットとなっている。
PE-22-28 効果
TREK-1とは?
スパジンとPE-22-28が結合する主なレセプターはTREK-1であり、多くの異なる分子によって制御されている2細孔のカリウムチャネルである。TREK-1は、神経細胞の興奮性を制御するのに重要な双極性カリウムチャネルの大きなファミリーに属している。特にTREK-1は、情動、記憶、学習を司る脳領域に存在する。これらの領域には、前頭前皮質、扁桃体、海馬が含まれる。TREK-1の活性を刺激すると神経細胞の興奮性が低下し、一方、TREK-1の機能を低下させると興奮性が高まり、脱分極現象が起こりやすくなる。神経細胞の興奮性を低下させることで、TREK-1は興奮毒性の予防に役立つと考えられる。
うつ病
うつ病モデルマウスを用いた研究では、PE-22-28は現在使用されているどの治療薬よりもうつ病の症状を回復させる効果があり、副作用も少ないことが示されています。実際、PE-22-28は、TREK-1チャネルによって制御される他の機能に副作用を及ぼすことなく、わずか4日でうつ病を緩和することが示されている。
うつ病やその他の感情障害の患者は海馬が小さい(容積が減少している)という強い証拠がある。さらに、古典的な抗うつ薬(5-HTまたはノルエピネフリン選択的再取り込み阻害薬)の長期投与により、成体げっ歯類の海馬における神経新生が促進され、海馬の容積が増大することが研究で示されている。PE-22-28 神経新生の刺激によってこの容積の減少を逆転させることができるということは、うつ病の根本原因に対抗していることを示唆しており、うつ病において基礎となる生理学的経路の一部が欠如していることを解明する一助となるかもしれない。
スパジンとPE-22-28が副作用を引き起こさないという事実は、これらのペプチドの役割と同じくらい重要である。うつ病の現在の治療法には、自殺から性欲の変化、認知の問題まで、多くの副作用が知られている。実際、副作用は抗うつ薬の使用を中止する第一の理由であり、うつ病が悪化しても抗うつ薬に戻りたがらない。うつ病の即効性のある治療薬として最近注目されているケタミンでさえ、せん妄、幻覚、筋肉の震え、高血圧、心拍数の増加など多くの副作用がある。そのため、医師たちは、ケタミンは即効性があるにもかかわらず、その副作用の範囲と重篤度から、うつ病への使用に消極的である。
当初は、TREK-1受容体が痛覚過敏、発作、心筋虚血と関連していることから、スパジンも様々な副作用を引き起こすことが懸念されていた。また、スパジンとPE-22-28がTREK-2、TRAAK、TASK、TRESKチャネルの電流を阻害し、さらなる副作用を引き起こすのではないかという懸念もあった。しかし、マウスを使った研究では、そのような副作用は観察されておらず、実際、PE-22-28は既存の、あるいは実験的なうつ病治療薬の中で最も副作用が少ないものの一つである。
脳卒中後うつ病
脳卒中後うつ病(PSD)は脳虚血後によくみられる病態であり、標準的な治療では特に治療が困難である。最近の研究では、TREK-1の過剰発現がこの病態の原因因子である可能性が示唆されている。実験的マウスモデルでは、SSRI抗うつ薬やSpadinのようなTREK-1遮断薬の使用により、この過剰発現を抑制または逆転させることができる。もちろん、SSRIは効くまでに時間がかかり、副作用も多い。このことは、PE-22-28がPSD治療において有効である可能性を示唆している。
神経発生
海馬の神経新生をアップレギュレートする抗うつ薬の能力は証明されている。PE-22-28を用いた研究では、このペプチドが同じ機能を発揮することが示されているが、その期間はより短い。マウスの研究では、PE-22-28はわずか4日後に神経新生とシナプス形成を増加させることが示された。予備的な結果では、PE-22-28は海馬のBrdU(DNAにドープされ、複製を検出するために使用される外因性マーカー)陽性細胞数を約2倍にした。シナプス形成の場合、PE-22-28はシナプス形成の速度を2倍にしたようである。
PE-22-28が脳の細胞分裂を促進するもう一つの手がかりは、PE-22-28投与後の、神経細胞の可塑性、記憶形成、空間記憶の発達に関与する転写因子であるCREB(cAMP-responsive element-binding protein)の増加である。アルツハイマー病の研究では、CREBのダウンレギュレーションが示されており、科学者たちは、アルツハイマー病を治療する手段として、CREBを増強する薬を長い間探してきた。PE-22-28は、アルツハイマー病の症状を予防し、逆転させる能力について活発に研究されている。
海馬はうつ病において重要な役割を果たしているが、学習と記憶にとっても重要な構造である。海馬は非常に柔軟な構造をしており、様々な損傷に対して脆弱であることが研究で示されている。海馬は、うつ病、不安神経症、アルツハイマー病などの疾患と関連している。損傷後の再生能力を向上させれば、これらの疾患の多くを治療できる可能性がある。特に、学習、記憶、空間ナビゲーションにおける海馬の役割は、PE-22-28あるいは同様のTREK-1アンタゴニストが効果的な知的促進剤であることを示唆している。
現在では、TREK-1チャネルの除去が破局につながることが動物モデルで一般的に証明されている。以前のマウスモデルでは、TREK-1のノックアウトは発作の可能性を著しく増加させ、興奮毒性からニューロンを保護するこの2細孔カリウムチャネルの正常な能力を低下させた。少し意外なことに、スパジンもPE-22-28も発作を増強しなかった。さらに興味深いことに、スパジンを投与したマウスは全般発作に対してより抵抗性があった。
筋肉機能
いくつかの研究から、TREK-1は筋肉が機械的刺激に応答する能力に重要な役割を果たしていることが示唆されている。特に、TREK-1の遮断は筋組織の収縮力を増加させるようであり、一方、チャネルの活性化は筋弛緩を促進するようである。TREK-1チャネルのこのような特殊な側面は、まだ研究の初期段階であるが、ますます重要になってきている。筋肉の収縮と弛緩におけるPE-22-28のような分子の役割を理解することは、筋原性膀胱機能障害のような疾患に対する新しい治療法を提供するだけでなく、筋肉のパフォーマンスの生理学を理解するための新しい道を開くことが期待される。
参考文献
- J.マゼラ 他"ネズミのTREK-1チャンネルを標的とするソルチリン由来ペプチド、スパジン:抗うつ薬デザインにおける新しいコンセプト"," PLoS Biol.vol. 8, no.4, p. e1000355, Apr. 2010, doi: 10.1371/journal.pbio.1000355.
- A.Djillani, M. Pietri, S. Moreno, C. Heurteaux, J. Mazella, and M. Borsotto, "Shortened Spadin Analogs Display Better TREK-1 Inhibition, In Vivo Stability and Antidepressant Activity,". フロント。Pharmacol.8巻、2017年9月、doi: 10.3389/fphar.2017.00643.
- A.Djillani, J. Mazella, C. Heurteaux, and M. Borsotto, "Role of TREK-1 in the Health and Disease, Focus on the Central Nervous System". フロント。Pharmacol.10巻、2019年4月、doi: 10.3389/fphar.2019.00379.
- R.S. Duman, S. Nakagawa, and J. Malberg, "Regulation of adult neurogenesis by antidepressant treatment," (抗うつ薬治療による成体神経新生の制御)。 Neuropsychopharmacol.Off.Publ.Am.Coll.Neuropsychopharmacol.25巻、6号、836-844頁、2001年12月、doi: 10.1016/S0893-133X(01)00358-X。
- J.E. Malberg and L. E. Schechter, "Increasing hippocampal neurogenesis: a novel mechanism for antidepressant drugs(海馬神経新生の増加:抗うつ薬の新規メカニズム)". Curr.Pharm.Des.11, no. 2, pp. 145-155, 2005, doi: 10.2174/1381612053382223.
- N.Katalinic, R. Lai, A. Somogyi, P. B. Mitchell, P. Glue, and C. K. Loo, "Ketamine as a new treatment for depression: a review of its efficacy and adverse effects,". オーストリア精神医学第47巻第8号、710-727頁、2013年8月、doi: 10.1177/0004867413486842.
- H.モハ・オウ・マーティ 他新規抗うつ薬としてのスパジン:TREK-1に関連した副作用の欠如", "Spadin as new antidepressant: absence of TREK-1-related side effects". 神経薬理学第62巻第1号、278-288頁、2012年1月、doi: 10.1016/j.neuropharm.2011.07.019。
- C.デベーダー 他新規抗うつ薬スパジンによるin vitroおよびin vivoでのシナプス形成制御"," Br.J. Pharmacol.172, no. 10, pp. 2604-2617, May 2015, doi: 10.1111/bph.13083.
- A.J.シルバ、J.H.コーガン、P.W.フランクランド、木田聡、"CREBと記憶" Annu.Rev. Neurosci.21巻、127-148頁、1998年、doi: 10.1146/annurev.neuro.21.1.127。
- T.B.リミテッドのC.、"メンタルヘルス:スパディン、即効性抗うつ薬"、" ディスモデルメカ3巻7-8号、398-398頁、2010年7月。
- Q.Lei, X.-Q.P. Malykhina, "Response of the human detrusor to stretch is regulated by TREK-1, a two-pore-domain (K2P) mechano-gated potassium channel,". J.Physiol.vol. 592, no. 14, pp. 3013-3030, Jul. 2014, doi: 10.1113/jphysiol.2014.271718.
本ウェブサイトで提供されるすべての記事および製品情報は、情報提供および教育目的のみのものです。
この医師/科学者は、理由の如何を問わず、本製品の購入、販売、使用を支持または推奨するものではありません。商船三井チェンジズは、この医師とは、黙示的か否かを問わず、いかなる提携関係も関係もありません。この医師を引用する目的は、このペプチドを研究している科学者による徹底的な研究開発の成果を認め、賞賛することにあります。
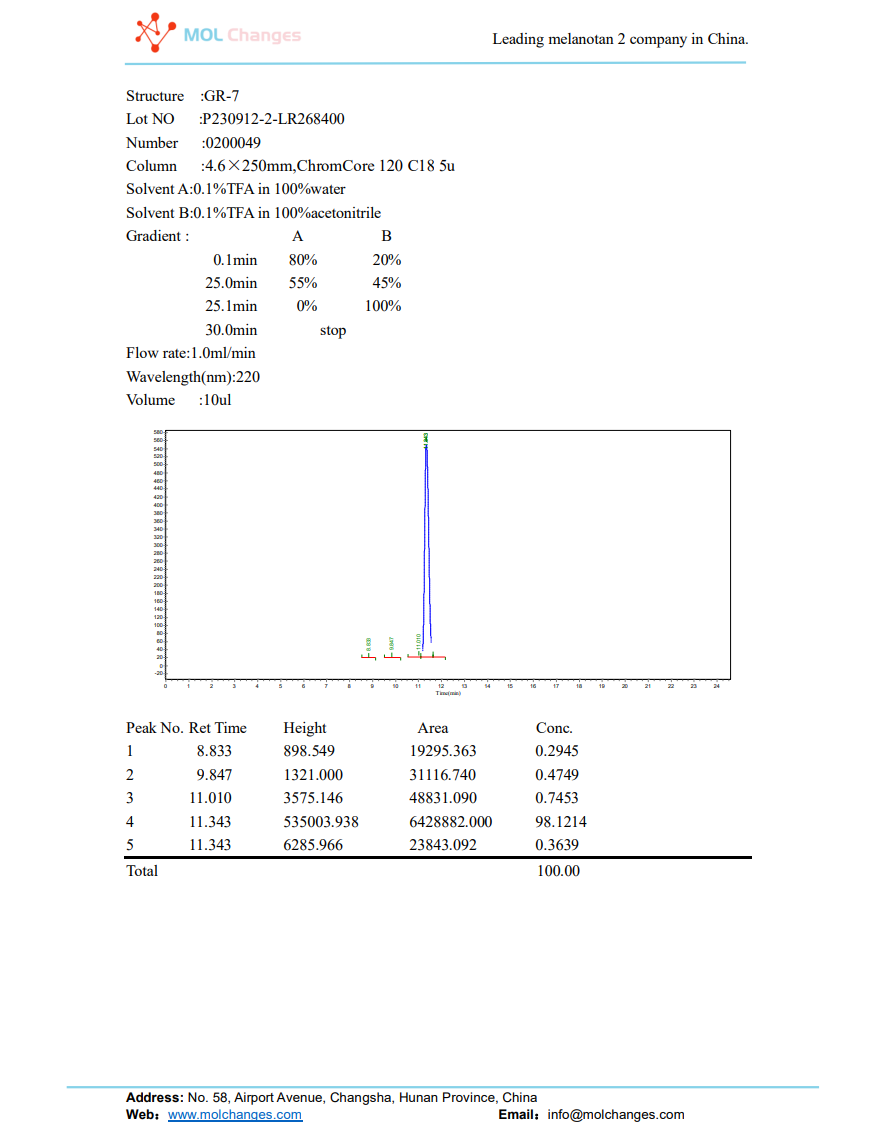
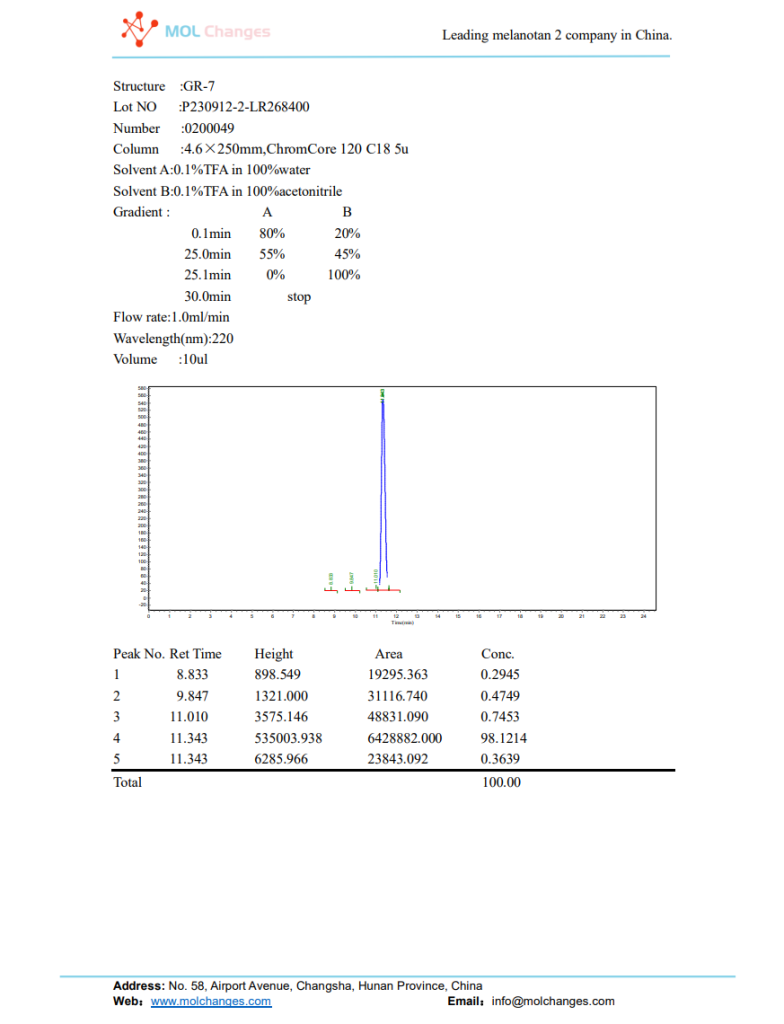
HPLC試験報告書
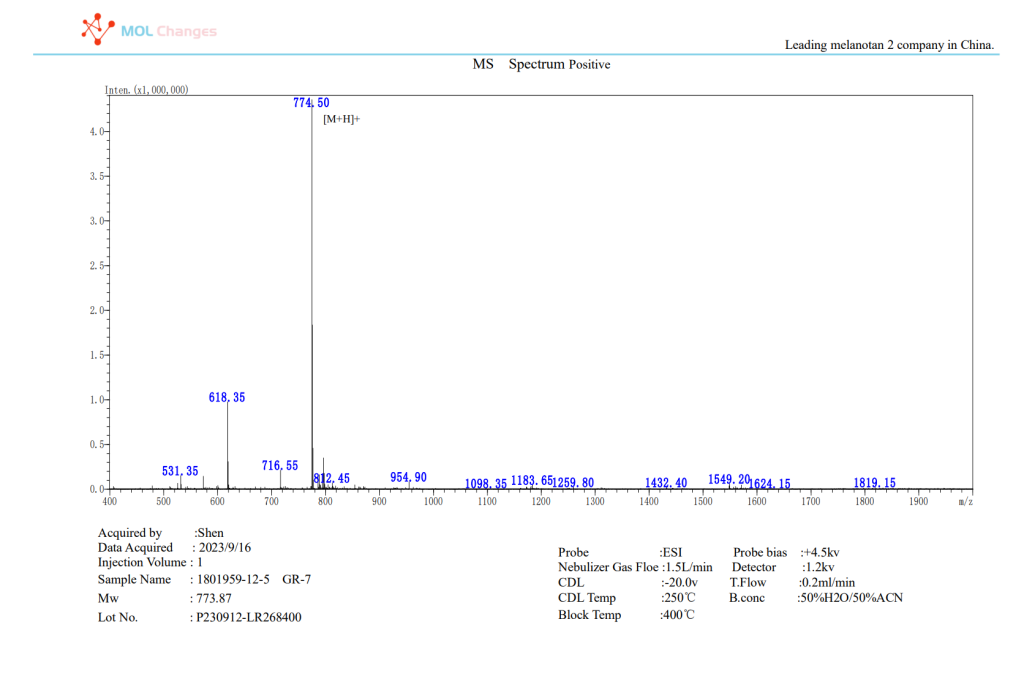
MSテストレポート
メーカー情報
- PE-22-28は商船三井Changes工場で製造。
- PE-22-28 サプライヤーMOLの変更。
- 最大許容生産量:100000本。
- 含有量基準:ネットペプチド。
- 純度:全製品で98%以上。
- カスタマイズ1mg-1g サイズのカスタマイズは受諾可能である